
【题目】某化合物A的结构简式为![]() ,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3)。C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
,为了研究X的结构,将化合物A在一定条件下水解只得到B(分子式为C8H8O3)和C(分子式为C7H6O3)。C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物A的分子式 。
(2)化合物B能发生下列反应类型的有________。
a.取代反应 b.加成反应 c.缩聚反应 d.消去反应
(3)化合物C能经下列反应得到G(分子式为C8H6O2,分子内含有五元环);

已知:(Ⅰ)RCOOH![]() RCH2OH;
RCH2OH;
(Ⅱ)经实验测定中间生成物E遇FeCl3显紫色;
(Ⅲ)R—Br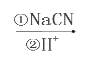 R—COOH。
R—COOH。
①确认化合物C的结构简式为__________________________。
②化合物E有多种同分异构体,其中某些同分异构体含有苯环,且苯环上有两种不同化学环境的氢,写出这些同分异构体中任意两种的结构简式:______________________________。
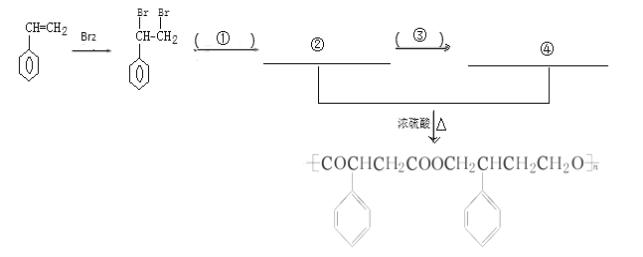
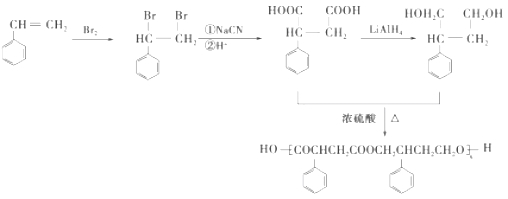
(4)完成下列以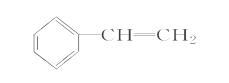 为主要原料制备
为主要原料制备
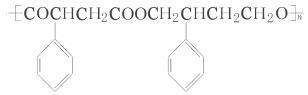 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。
【答案】(1)C15H12O5 (2)abc
(3)①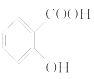
②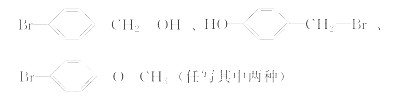
(4)
【解析】
试题分析:C(分子式为C7H6O3)。C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生,C遇FeCl3水溶液显紫色,与NaHCO2溶液反应有CO2产生,说明C中含有酚羟基和羧基,结合A的结构简式、B的分子式、C的分子式知,X前边的属于B中部分,所以B的结构简式为: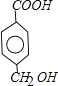 ,根据B的结构简式确定其具有的性质。C中含有羧基和酚羟基,根据RCOOH
,根据B的结构简式确定其具有的性质。C中含有羧基和酚羟基,根据RCOOH![]() RCH2OH知,C中的羧基被含有生成醇羟基,所以D中含有酚羟基和醇羟基,D中醇羟基和氢溴酸发生取代反应生成E,E中含有酚羟基和溴原子,根据R—Br
RCH2OH知,C中的羧基被含有生成醇羟基,所以D中含有酚羟基和醇羟基,D中醇羟基和氢溴酸发生取代反应生成E,E中含有酚羟基和溴原子,根据R—Br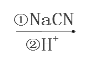 R—COOH知,E中溴原子被取代生成羧基,在浓硫酸作催化剂、加热条件下,F发生酯化反应生成G,分子式为C8H6O2,分子内含有五元环,所以F发生分子内酯化反应生成G,则F的结构简式为:
R—COOH知,E中溴原子被取代生成羧基,在浓硫酸作催化剂、加热条件下,F发生酯化反应生成G,分子式为C8H6O2,分子内含有五元环,所以F发生分子内酯化反应生成G,则F的结构简式为: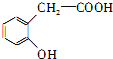 ,G的结构简式为:
,G的结构简式为:![]() ,C的结构简式为:
,C的结构简式为: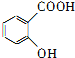 ,D的结构简式为:
,D的结构简式为: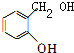 ,E的结构简式为:
,E的结构简式为: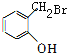 ,A的结构简式为:
,A的结构简式为:![]() ;(1)A的结构简式知,
;(1)A的结构简式知,![]() ,A的分子式是C15H12O5;
,A的分子式是C15H12O5;
(2)B的结构简式为: ,所以B能发生取代反应、加成反应和缩聚反应;
,所以B能发生取代反应、加成反应和缩聚反应;
(3)①C的结构简式为: ;
;
②符合条件的E的同分异构体为:![]() ,
,
(4)苯乙烯和溴发生加成反应生成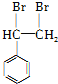 ,
,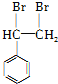 和氰化钠反应,然后酸化生成
和氰化钠反应,然后酸化生成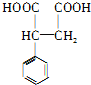 ,
, 被还原生成
被还原生成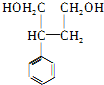 ,
, 和
和 发生酯化反应生成
发生酯化反应生成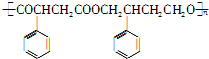 ,所以其合成路线为:
,所以其合成路线为:
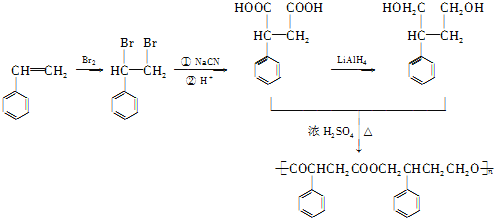 ,
,


科目:高中化学 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一,它可由下列方法合成。下列说法正确的是( )

A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入适量的NaHCO3有利提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO4-+5e-+8H+===Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:_______________________。
(2)反应中氧化剂是________;被氧化元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为____________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填序号)______________。
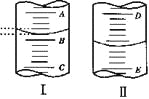
a.是amL b.是(50-a)mL
c.一定大于amL d.一定大于(50-a)mL
(3)如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图。

请指出A、B、C、D分别与①②③④相匹配的可能组合:
A与 ; B与 ;
C与 ; D与 。
(4) 某兴趣小组要进行有关氢气的定量测定实验,为保证氢气不损失,设计用甲、乙两装置及橡胶管完成锌粒和稀硫酸制取氢气的操作。
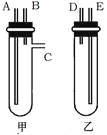
步骤如下:
①将锌粒放于 (填“甲”或“乙”,下同)装置中,将稀硫酸放于 装置中。
②用橡胶管连接对应接口(填编号):A接 ,B接 。
③将盛稀硫酸的试管倒置,即可发生反应放出气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

已知:
①A的相对分子酯为58,氧元素质量分数为0.276,核磁共振氢谱显示为单峰
②
回答下列问题:
(1)A的化学名称为_______。
(2)B的结构简式为______,其核磁共振氢谱显示为______组峰,峰面积比为______。
(3)由C生成D的反应类型为________。
(4)由D生成E的化学方程式为 。
(5)G中的官能团有 。(填官能团名称)
(6)G的同分异构体中,与G具有相同官能团且能发生银镜反应的共有_____种。(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族) ;
(2)8个元素的最高价氧化物的水化物中,酸性最强的是 (填化学式);
(3)元素⑤、⑦、⑧分别形成的简单气态氢化物中,⑦的电子式为 ,稳定性最强的氢化物的结构式为 ;
(4)写出①、④的最高价氧化物对应的水化物之间发生反应的离子方程式 ;
(5)用电子式表示元素①与⑥形成化合物的过程 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知20℃时的溶解度:Na2CO3:S=21.2g; NaHCO3:S=9.6g。则20oC恒温条件下向121.2g饱和碳酸钠溶液中通入足量的CO2气体,理论上可以析出NaHCO3__________g(小数点后保留1位)
(2)向500mL KOH溶液中缓慢通入一定量的![]() 气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入
气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。若通入![]() 气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
气体为2.24L(标准状况下),得到11.9g的白色固体。则所用的KOH溶液的物质的量浓度为______mol/L。
(3)将一定质量的钠加入到89g水中,完全反应后的溶液为100g,则该溶液的质量分数为________
(4)现有甲、乙两瓶无色溶液,已知它们可能是AlCl3溶液和NaOH溶液.现做如下实验:
① 取440mL甲与120mL乙反应,产生1.56g沉淀;
② 取440mL乙与120mL甲反应,也产生1.56g沉淀;
③ 取120mL甲溶液与400mL乙溶液反应,则产生3.12g沉淀;
通过必要的计算和推理判定:
甲溶液为 溶液,其物质的量浓度为 mol·L-1;
乙溶液为 溶液,其物质的量浓度是 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
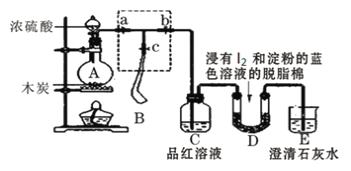
(1)装置A中盛放浓硫酸的仪器名称______________。
(2)装置A中发生反应的化学方程式为___________________________________。
(3)实验时,装置C中的现象为_______________________________________。
(4)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是_________________(用操作编号填写)。
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(5)当D中产生_________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;写出D中发生反应的化学方程式_______________________________________,当D中反应发生0.3mol电子转移时,发生反应的气体的体积(标准状况)是_____________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com