
【题目】已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是ΔH1=-285.8kJ/mol、ΔH2=-1411.0kJ/mol和ΔH3=-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A. -44.2kJ/mol B. +44.2kJ/mol C. -330kJ/mol D. +330kJ/mol
【答案】A
【解析】已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则有:①H2(g)+ ![]() O2(g)=H2O(l)△H=-285.8kJ/mol;②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g)△H=-1366.8kJ/mol;根据盖斯定律,将②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,故选A。
O2(g)=H2O(l)△H=-285.8kJ/mol;②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g)△H=-1366.8kJ/mol;根据盖斯定律,将②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,故选A。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①标准状况下,0.2 mol任何物质的体积均为4.48 L ②若1 mol气体的体积为22.4 L,则它一定处于标准状况下 ③标准状况下,1 L HCl和1 L H2O的物质的量相同 ④标准状况下,1 g H2和14 g N2的体积相同 ⑤28 g CO的体积为22.4 L ⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同 ⑦在同温同体积时,气体物质的物质的量越大,则压强越大 ⑧同温同压下,气体的密度与气体的相对分子质量成正比
A. ①②③④ B. ②③⑥⑦⑧ C. ⑤⑥⑦⑧ D. ④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用下列装置欲验证CaSO4与炭粉受热发生氧化还原反应,且还原产物是SO2。下列有关说法不正确的是
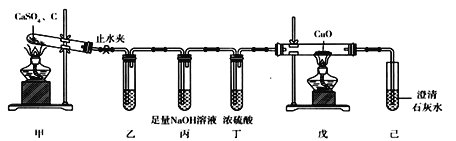
A. 装置乙欲验证气体中的还原产物,故乙中盛有CaSO4溶液
B. 装置丙和装置丁的作用是除去SO2和其他杂质气体
C. 装置戊中黑色粉末变红,己中出现白色沉淀,说明氧化产物有CO
D. 实验结束时,应该先关闭止水夹,再迅速熄灭装置甲中的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 1 mol B和3 mol C
B. 2 mol A、1mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C
D. 2 mol A、3mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是_____(填字母)。
a.电子从基态跃迁到较高的激发态 b.电子从较高的激发态跃迁到基态
c.焰色反应的光谱属于吸收光谱 d.焰色反应的光谱属于发射光谱
(2)基态Cu原子中,核外电子占据的最高能层符号是_____,其核外电子排布式中未成对电子数为______个,Cu与Ag均属于IB族,熔点:Cu____Ag(填“>”或“<”)。
(3)[Cu(NH3)4]SO4中阴离子的立体构型是_________;中心原子的轨道杂化类型为__________,[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为________________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛中σ键和π键的比值为___________。
(5)碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
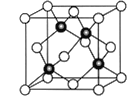
(6)Cu与Cl形成某种化合物的晶胞如图所示,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为__________(用含ρ、a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值下列有关叙述正确的是
A. 常温常压下, 30 g乙烷中所含的极性共价键数为6NA
B. 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
C. 0.1 mol![]() Sr原子中含中子数为3.8NA
Sr原子中含中子数为3.8NA
D. 0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com