
【题目】设NA为阿伏加德罗常数值下列有关叙述正确的是
A. 常温常压下, 30 g乙烷中所含的极性共价键数为6NA
B. 0.1mol Fe与足量盐酸反应,转移的电子数为0.3NA
C. 0.1 mol![]() Sr原子中含中子数为3.8NA
Sr原子中含中子数为3.8NA
D. 0.1mol·L-1的NH4NO3溶液中含有的氮原子数为0.2NA
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
B. 乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键
C. 凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形
D. 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是ΔH1=-285.8kJ/mol、ΔH2=-1411.0kJ/mol和ΔH3=-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A. -44.2kJ/mol B. +44.2kJ/mol C. -330kJ/mol D. +330kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯分子中的化学键的描述正确的是 ( )
A. 每个碳原子的sp2杂化轨道中的一个形成大π键
B. 每个碳原子的未参加杂化的2p轨道形成大π键
C. 碳原子的三个sp2杂化轨道只形成两个σ键
D. 碳原子的未参加杂化的2p轨道形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2+O22SO3 , 在某密闭容器中达到化学平衡状态后,再往此容器中通入18O2 , 较长时间后,下列有关说法中正确的是( )
A.18O原子只存在氧气中
B.18O原子只存在三氧化硫中
C.18O一定不存在二氧化硫中
D.氧气中,二氧化硫中,三氧化硫中都可能存在18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()
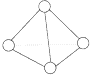
A. N4的熔点比P4高
B. 1 mol N4气体转化为N2时要吸收724 kJ能量
C. N4是N2的同系物
D. 1 mol N4气体转化为N2时要放出724 kJ能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com