
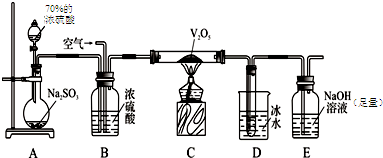
| ||||
|
| 4a |
| 4a+5b |
| 4a |
| 4a+5b |


科目:高中化学 来源: 题型:阅读理解
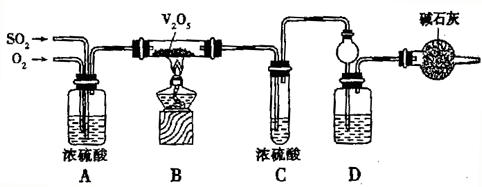
| 1 |
| 2 |
| 1 |
| 2 |
| ||||
|
| ||||
|
查看答案和解析>>
科目:高中化学 来源: 题型:
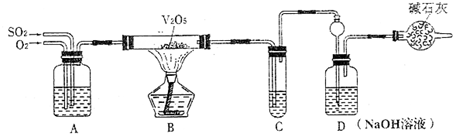
| 1 |
| 2 |
| 1 |
| 2 |
| ||||
|
| ||||
|
查看答案和解析>>
科目:高中化学 来源: 题型:
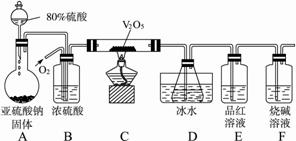
请填空:
(1)装置B的三个作用是① ;② ;③ 。
(2)实验过程中,当V2O5表面红热后,应将酒精灯移开一会儿后再继续加热,其原因是 。
(3)D中锥形瓶中盛放的溶液可以是(选填序号) 。
①足量澄清石灰水 ②足量小苏打溶液
③足量氯化钡溶液 ④足量硝酸钡溶液
反应停止后,根据装置D锥形瓶中产生的白色沉淀的量,测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行的一步实验操作是(简述过程) 。
(4)若从锥形瓶溶液中得到的沉淀质量为m g。要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是(选填序号) ,二氧化硫的转化率是 (用含有m、a、b、c、d中的一种或几种字母的代数式表示)。
①装置F增加的质量a g
②装置A中亚硫酸钠减少的质量b g
③装置B增加的质量c g
④装置E增加的质量d g
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省高三上学期第三阶段考试化学试卷(解析版) 题型:实验题
实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。

(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为 。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ ,装置Ⅱ ,装置Ⅲ 。
(3)开始进行实验时,首先应进行的操作是 。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会 (填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是 (用含字母的代数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com