
 ,故答案为:非极性分子;水分子间存在氢键;
,故答案为:非极性分子;水分子间存在氢键; ;
;
| ||
| ||
| ||
| 1 |
| 4 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| A、R>M>Z |
| B、M>R>Z |
| C、M>Z>R |
| D、Z>M>R |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
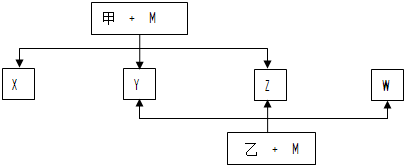
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
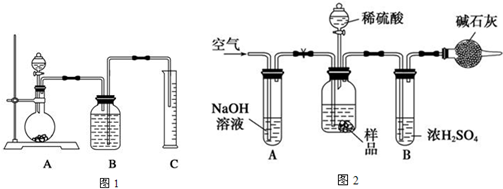
科目:高中化学 来源: 题型:
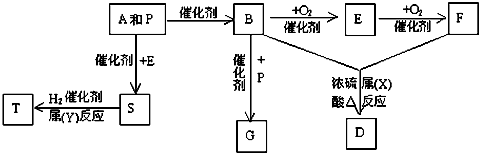
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、保存三甲基一氯硅时应密封防水 |
| B、扑灭三甲基一氯硅引发的着火,应使用二氧化碳、干粉灭火剂,并用弱碱性水处理 |
| C、三甲基一氯硅水溶液pH小于7 |
| D、三甲基一氯硅由碳、氢、硅、氯四个原子构成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com