
【题目】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
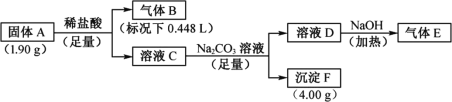
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件下可生成乌洛托品(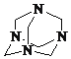 学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
Ⅱ.某兴趣小组为探究H2S和Cl2O的性质,将两种气体同时通入水中,实验装置如图:
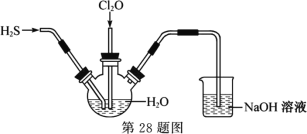
请回答:
(1) 三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________。
(2) 若通入水中的Cl2O已过量,设计实验方案检验________。
【答案】Ca、H和N Ca2HN Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl 4NH3+6HCHO→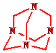 (或C6H12N4)+6H2O 2H2S+Cl2O=2S↓+2HCl+H2O 用玻璃棒蘸取清液,点到KI淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量
(或C6H12N4)+6H2O 2H2S+Cl2O=2S↓+2HCl+H2O 用玻璃棒蘸取清液,点到KI淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量
【解析】
Ⅰ.由溶液C焰色反应为砖红色可知,溶液C中含有钙元素,由气体E能使湿润的红色石蕊试纸变蓝可知,气体E为氨气,则C中含有氯化铵,C为氯化钙和氯化铵的混合溶液,则固体A中含有钙元素和氮元素,由固体A与足量盐酸反应结合质量守恒定律可知,气体B为氢气,固体A中还含有氢元素,则固体A中含有Ca、N和H三种元素。
Ⅱ.由题意可知,H2S和Cl2O发生氧化还原反应生成硫、氯化氢和水,反应中H2S中硫元素化合价升高被氧化,Cl2O中氯元素化合价降低被还原。
Ⅰ.(1)由分析可知,组成A的三种元素是Ca、N和H,由钙原子个数守恒可知,固体A中钙的物质的量为![]() =0.04mol,质量为0.04mol×40g/mol=1.6g,固体A与足量盐酸反应时,固体A中氢元素化合价升高被氧化,HCl中氢元素化合价降低被还原,由得失电子数目守恒和原子个数守恒可知,固体A中氢的物质的量为
=0.04mol,质量为0.04mol×40g/mol=1.6g,固体A与足量盐酸反应时,固体A中氢元素化合价升高被氧化,HCl中氢元素化合价降低被还原,由得失电子数目守恒和原子个数守恒可知,固体A中氢的物质的量为![]() ×2×
×2×![]() =0.02mol,质量为0.02mol×1g/mol=0.02g,则固体A中氮的物质的量为
=0.02mol,质量为0.02mol×1g/mol=0.02g,则固体A中氮的物质的量为![]() =0.02mol,A中Ca、N和H的物质的量比为0.04mol: 0.02mol: 0.02mol=2:1:1,化学式为Ca2HN,故答案为:Ca、H和N ;Ca2HN;
=0.02mol,A中Ca、N和H的物质的量比为0.04mol: 0.02mol: 0.02mol=2:1:1,化学式为Ca2HN,故答案为:Ca、H和N ;Ca2HN;
(2)Ca2HN与足量盐酸反应时,Ca2HN中氢元素化合价升高被氧化,HCl中氢元素化合价降低被还原,反应生成氯化钙、氯化铵和氢气,反应的化学方程式为Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl,故答案为:Ca2HN+5HCl=2CaCl2+H2↑+NH4Cl;
(3)氨气与甲醛反应生成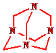 和水,反应的化学方程式为4NH3+6HCHO→
和水,反应的化学方程式为4NH3+6HCHO→ (或C6H12N4)+6H2O,故答案为4NH3+6HCHO→
(或C6H12N4)+6H2O,故答案为4NH3+6HCHO→ (或C6H12N4)+6H2O;
(或C6H12N4)+6H2O;
Ⅱ.(1)由三颈瓶中出现淡黄色沉淀,溶液呈强酸性可知,H2S和Cl2O发生氧化还原反应生成硫、氯化氢和水,反应的化学方程式为2H2S+Cl2O=2S↓+2HCl+H2O,故答案为:2H2S+Cl2O=2S↓+2HCl+H2O;
(2) Cl2O具有强氧化性,若通入水中的Cl2O已过量,过量的Cl2O能与碘化钾溶液反应生成单质碘,单质碘能使淀粉溶液变蓝色,则检验Cl2O已过量的实验方案为用玻璃棒蘸取清液,点到KI淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量,故答案为:用玻璃棒蘸取清液,点到KI淀粉试纸上,如果变蓝(或变蓝后再褪色),说明Cl2O过量。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
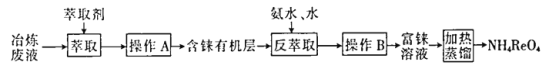
【题目】CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在):
回答下列问题:
(1)NH4ReO4(高铼酸铵)中铼元素化合价为_________________。
(2)操作A的名称是_____________。
“萃取”中萃取剂应具有的性质:______(填代号)。
①萃取剂难溶于水 ②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度 ④萃取剂不和ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高温下高铼酸铵分解生成Re2O7,用氢气还原Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成Re2O7的化学方程式_____________________。
②工业上,利用氢气还原Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,其原因是_____________________。
(5)工业上,高温灼烧含ReS2的矿粉,可以制备R2O7。以含ReS2的矿石原料生产48.4tRe2O7,理论上转移__________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、Y、Z、Q、R、T 分别代表原子序数依次增大的短周期元素。元素A是原子半径最小的元素;X、Y、Z同周期且相邻,都是蛋白质的组成元素;X、R同族,Q与T原子的最外层电子数之和是R原子最外层电子数的2倍,T单质为淡黄色固体。U是d区元素,U2+的核外最高能级有2对成对电子。请回答下列问题:
(1)Y元素在周期表中的位置______,位于周期表______区;Q原子的核外电子排布式为______。
(2)X、Y、Z元素的第一电离能由大到小的顺序是______。
(3)TZ3分子为______分子(填“极性”或“非极性”),YZ2–离子实际构型是______。
(4)Z和T的简单气态氢化物稳定性好的是______(填化学式),原因是______。
(5)A、X、Z可形成分子式为A2XZ的有机物,则该化合物分子中X原子的轨道杂化类型是______;1mol该分子中含有π键的数目是______。(用“NA”表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.36g冰(图甲)中含共价键数目为4NA
B.12g金刚石(图乙)中含有σ键数目为4NA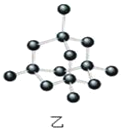
C.44g干冰(图丙)中含有NA个晶胞结构单元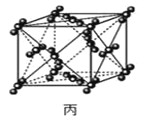
D.12g石墨(图丁)中含σ键数目3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()
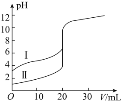
A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NOx之间的转化具有重要意义。
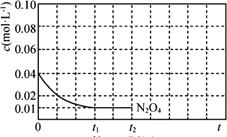
(1)已知:N2O4(g) ![]() 2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
2NO2(g) ΔH>0 将一定量N2O4气体充入恒容的密闭容器中,控制反应温度为T1。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.v正(N2O4)=2v逆(NO2) C.K不变 D.容器内气体的密度不变 E.容器内颜色不变
②t1时刻反应达到平衡,混合气体平衡总压强为p,N2O4气体的平衡转化率为75%,则反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
2NO2(g)的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
③反应温度T1时,c(N2O4)随t(时间)变化曲线如图,画出0~t2时段,c(NO2)随t变化曲线。保持其它条件不变,改变反应温度为T2(T2>T1),再次画出0~t2时段,c(NO2)随t变化趋势的曲线________。
(2) NO氧化反应:2NO(g)+O2(g)=2NO2(g)分两步进行,其反应过程能量变化示意图如图。
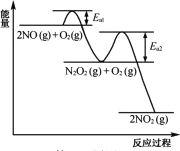
Ⅰ 2NO(g)=N2O2(g) ΔH1
Ⅱ N2O2(g)+O2(g)→2NO2(g) ΔH2
①决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
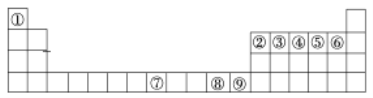
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式______。
(3)②、⑥两元素形成的化合物其中心原子的杂化轨道类型为___。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于____晶体(填晶体类型)。
(5)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水,该离子与NH3间结合的作用力为____。
(6)将①、⑥形成的化合物溶于水,其与水间可能存在的氢键表示为____________(写一种即可)。
(7)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为________。
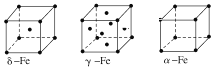
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,请回答下列问题:
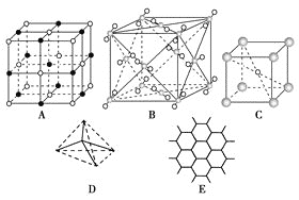
(1)代表金刚石的是(填编号字母,下同)___,其中每个碳原子与____个碳原子最近且距离相等。金刚石属于____晶体。
(2)代表石墨的是____,每个正六边形占有的碳原子数平均为____个。
(3)代表NaCl的是___,每个Na+周围与它最近且距离相等的Na+有___个,每个Na+周围与它最近且距离相等的Cl-有___个。
(4)代表CsCl的是___,它属于____晶体,每个Cs+与____个Cl-紧邻。
(5)代表干冰的是___,它属于___晶体,每个CO2分子与___个CO2分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为____(用名称回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应。
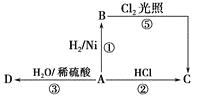
据图回答下列问题:
(1)写出A、C、D的结构简式:
A________,C________,D________。
(2)写出①②两步反应的化学方程式,并注明反应类型:
①________________________________(反应类型____________)。
②________________________________(反应类型____________)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com