
【题目】合金是建造航空母舰的主体材料.
(1)航母升降机可由铝合金制造.
①铝元素在周期表中的位置为 ______ ![]() 工业用铝土矿冶炼铝的化学方程式 ______ .
工业用铝土矿冶炼铝的化学方程式 ______ .
②![]() 合金焊接前用NaOH溶液处理
合金焊接前用NaOH溶液处理![]() 膜,其化学方程式为 ______ .
膜,其化学方程式为 ______ .
(2)![]() 也是重要的铝盐,其无水
也是重要的铝盐,其无水![]() 升华
升华![]() 遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
遇潮湿空气即产生大量白雾,实验室可用下列装置制备.
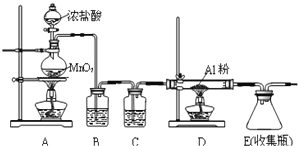
①装置在实验开始前应 ______ ,操作方法是: ______ .
②装置B中盛放饱和NaCl溶液,该装置的主要作用是 ______ ![]() 装置C中盛放 ______ .
装置C中盛放 ______ .
③装置A中发生的离子反应 ______ .
④该装置缺少尾气处理装置,尾气处理装置用的仪器是 ______ 装碱石灰.
【答案】第三周期第ⅢA族 ![]() 熔融
熔融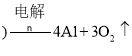
![]() 检查气密性 将止水夹夹于E装置后的橡胶管上,在分液漏斗中加入水,打开分液漏斗的瓶塞和下端活塞,若无持续水滴滴下,则气密性良好 除去HCl 浓硫酸
检查气密性 将止水夹夹于E装置后的橡胶管上,在分液漏斗中加入水,打开分液漏斗的瓶塞和下端活塞,若无持续水滴滴下,则气密性良好 除去HCl 浓硫酸 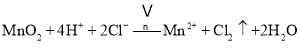 干燥管
干燥管
【解析】
(1)①Al的原子结构中有3个电子层,最外层电子数为3;电解氧化铝制备Al;
②NaOH溶液处理Al2O3膜,反应生成偏铝酸钠和水;
(2)①反应制备氯气,则实验前检查装置的气密性;
②无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,则装置B除去挥发的HCl,装置C干燥氯气;
③A中发生浓盐酸和二氧化锰的反应,生成氯化锰、氯气和水;
④尾气中含氯气,利用固体干燥剂吸收,则选干燥管。
![]() 的原子结构中有3个电子层,最外层电子数为3,位于第三周期第ⅢA族;电解氧化铝制备Al,反应为2Al2O3(熔融)
的原子结构中有3个电子层,最外层电子数为3,位于第三周期第ⅢA族;电解氧化铝制备Al,反应为2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
![]() 溶液处理
溶液处理![]() 膜,反应生成偏铝酸钠和水,反应为
膜,反应生成偏铝酸钠和水,反应为![]() ;
;
![]() 反应制备氯气,则实验前检查装置的气密性,则实验前检查气密性,操作方法为将止水夹夹于E装置后的橡胶管上,在分液漏斗中加入水,打开分液漏斗的瓶塞和下端活塞,若无持续水滴滴下,则气密性良好;
反应制备氯气,则实验前检查装置的气密性,则实验前检查气密性,操作方法为将止水夹夹于E装置后的橡胶管上,在分液漏斗中加入水,打开分液漏斗的瓶塞和下端活塞,若无持续水滴滴下,则气密性良好;
![]() 无水
无水![]() 升华
升华![]() 遇潮湿空气即产生大量白雾,则装置B除去挥发的HCl,装置C干燥氯气,则B中盛放饱和NaCl溶液,该装置的主要作用是除去HCl,装置C中盛放浓硫酸;
遇潮湿空气即产生大量白雾,则装置B除去挥发的HCl,装置C干燥氯气,则B中盛放饱和NaCl溶液,该装置的主要作用是除去HCl,装置C中盛放浓硫酸;
![]() 中发生浓盐酸和二氧化锰的反应,生成氯化锰、氯气和水,离子反应为MnO2+4H++2Cl-
中发生浓盐酸和二氧化锰的反应,生成氯化锰、氯气和水,离子反应为MnO2+4H++2Cl-![]() Cl2↑+Mn2++2H2O;
Cl2↑+Mn2++2H2O;
![]() 尾气中含氯气,利用固体干燥剂吸收,则选干燥管,大口进气,小口出气。
尾气中含氯气,利用固体干燥剂吸收,则选干燥管,大口进气,小口出气。


科目:高中化学 来源: 题型:
【题目】原电池的开发和利用是化学学科对人类的一项重大贡献。
(1)某兴趣小组为研究原电池的工作原理,设计了如图所示的实验装置。
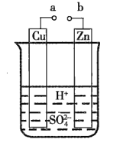
①a和b不连接时,烧杯中发生反应的离子方程式是__。
②a和b用导线连接,Cu极为原电池__(填“正”或“负”)极,电极反应式是__。Zn极发生__(填“氧化”或“还原”)反应。溶液中H+移向__(填“Cu”或Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻__g。
(2)有同学想将Ba(OH)2·8H2O与NH4Cl的反应设计成原电池,你认为是否可行?__(填是”或“否”),理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的两种组成,可以发生如图转化,下列说法不正确的是
离子中的两种组成,可以发生如图转化,下列说法不正确的是![]()
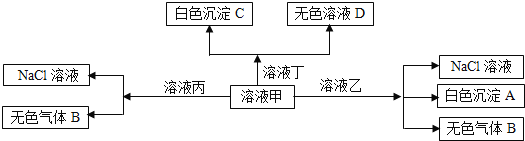
A.在甲中滴加丁可能发生反应:![]()
B.溶液丙中还可以大量共存的离子有:![]() 、
、![]() 、
、![]()
C.白色沉淀A可能溶解在溶液D中
D.甲为![]() ,乙为
,乙为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m、n、x、y四种主族元素在周期表的相对位置如图所示。已知它们的原子序数总和为46,则:
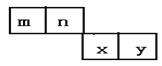
(1)元素n的气态氢化物的电子式为___,基态n原子的核外共有__种不同运动状态的电子。
(2)m与y所形成的化合物含___键,属___分子。(填“极性”或“非极性”)
(3)x位于周期表的第___周期第___族;其简单离子的离子结构示意图为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式表示正确的是 ( )
A.碳酸钙与醋酸溶液反应:CaCO3 +2H+ =Ca2++ CO2 ↑+H2O
B.苯酚钠溶液和少量CO2反应: 2C6H5O +CO2 +H2O=2C6H5OH +CO32
C.溴乙烷与氢氧化钠溶液共热:C2H5Br+OH ![]() C2H5OH+Br
C2H5OH+Br
D.用银氨溶液检验乙醛的醛基:CH3CHO + 2Ag(NH4)2OH ![]() CH3COO- + NH4+ +3NH3 + 2Ag↓+H2O
CH3COO- + NH4+ +3NH3 + 2Ag↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
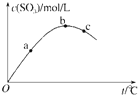
A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况,离子可能大量共存的是( )
A.Al3+、Na+、Cl-、CO32-
B.25℃,水电离出的OH-浓度为10-11mol/L的溶液中:K+、Na+、SO32-、NO3-
C.![]() =10-2溶液中:Cu2+、Na+、Cl-、NO3-
=10-2溶液中:Cu2+、Na+、Cl-、NO3-
D.无色溶液中:H+、Fe2+、Cl-、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型可逆电池的工作原理如下图所示。放电时总反应为:Al+3Cn(AlCl4)+4AlCl4-![]() 4Al2Cl7-+3Cn(Cn表示石墨)。
4Al2Cl7-+3Cn(Cn表示石墨)。

下列说法正确的是
A. 放电时负极反应为:2Al-6e-+7Cl-= Al2Cl7-
B. 放电时AlCl4-移向正极
C. 充电时阳极反应为: AlCl4-e-+Cn=Cn(AlCl4)
D. 电路中每转移3mol电子,最多有1molCn(AlCl4)被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式为________________。
②NO![]() 的空间构型__________(用文字描述)。
的空间构型__________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①CO分子的等电子体有______。(至少写两个)
②HCHO分子中C原子轨道的杂化类型为______。
③1 mol CO2中含有的σ键与π键数目之比为_____。
④CO还能以配体形式与金属形成配合物,如Fe(CO)5,1mol Fe(CO)5中π键数目为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com