
关于化学键的叙述中,正确的是( )
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.离子化合物中一定含有金属离子
 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
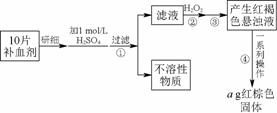
图95
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加____________,该过程的现象为________________________。
(2)步骤②加入过量H2O2的目的是________________________________________________________________________
________________________________________________________________________。
(3)步骤③中反应的离子方程式是________________________________________________________________________
________________________________________________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、________________________________________________________________________、
灼烧、________、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)右图所示的原电池装置中,其负极材料是 ,正极上能够观察到的现象是 ,正极的电极反应式是 。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。
(2)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O,据此判断:铅蓄电池的负极材料是________。工作时,电解质溶液的酸性________(填“增大”、“减小”或“不变”)。工作时,电解质溶液中阴离子移向_______极(填“正”或“负”)。电子流动方向为从_______极流向_______极(填“正”或“负”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知某化学反应的平衡常数表达式为 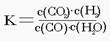 , 在不同的温度下该反应的平
, 在不同的温度下该反应的平
衡常数如下表:
| t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在1 L的密闭容器中通入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO2为0.4 mol,该反应达到平衡状态
D.若平衡浓度符合关系式 ,则此时的温度为1 000 ℃
,则此时的温度为1 000 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
学生用铝片分别和稀盐酸、稀硫酸反应发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
铝与酸反应的情况。结果如下:
反应进程(分钟) 1 2 5 15 20
3.0mol/L盐酸 少量气泡 较多气泡 大量气泡 反应剧烈 铝片耗尽
1.5mol/L硫酸 均无明显现象(无气泡产生)
3.0mol/L硫酸 均无明显现象(无气泡产生)
通过上述实验可知,无论是用1.5mol/L 硫酸还是3.0mol/L 硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)反应1~15min 内,铝与盐酸的反应速率逐渐加快,其主要原因是
__________________________ 。
(2)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:_________________________________________________________________
假设二:_________________________________________________________________
(3)通过你的思考,教材中H2O2的分解所用的催化剂(FeCl3和CuSO4)这个实验(关于催化剂对化学反应速率的影响)也需要改进,才具有说服力,应怎样改进
________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
氯元素的相对原子质量为35.5,氯只有35Cl和37Cl两种稳定同位素,在氯气中35Cl和37Cl的原子个数比为3∶1,则相对分子质量为70,72,74的氯气分子数之比可能是( )
A.5∶3∶2 B.5∶2∶2
C.5∶2∶1 D.9∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石< 石墨
d.晶体中共价键的键角:金刚石>石墨
 (2)某石蕊的分子结构如右图所示。
(2)某石蕊的分子结构如右图所示。
①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式);
②该石蕊易溶解于水,分析可能的原因是 ;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F
NF3+3NH4F
 上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②金属铜采取如图所示堆积方式,可称为_____堆积,则Cu晶体中
Cu原子的配位数为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
 A.分馏、蒸馏馏都是物理变化,干馏、裂化、裂解都是化学变化
A.分馏、蒸馏馏都是物理变化,干馏、裂化、裂解都是化学变化
B.乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色
C.丹参素结构如图所示,能发生取代、加成、氧化反应
D.中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com