
科目:高中化学 来源: 题型:
已知  (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构。试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构。试推断一氯丙烯的同分异构体(不含环状结构)有( )
A.3种 B.4种
C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
关于基团的相互影响,下列说法错误的是( )
A.苯酚浊液中加NaOH溶液变澄清,说明受苯环影响—OH中H原子活泼性增强
B.与钠反应时乙醇比水慢,说明受乙基影响乙醇的-OH中H原子活泼性减弱
C.甲苯能使酸性KMnO4溶液褪色,说明受甲基影响,苯环易被氧化
D.苯酚溶液中加浓溴水生成白色沉淀,说明受-OH影响苯环变得活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的密闭容器中,进行如下化学反应: CO2(g)+H2(g ) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
| T/°C | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为________反应(填“吸热”“放热”)。
(2)能判断该反应是否已达化学平衡状态的依据是________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.混合气体的平均密度不变
(3)某温度下,在2 L的密闭容器中,加入1 mol CO2和1 mol H2充分反应达平衡时,CO的平衡浓度为0.25 mol·L-1,试判断此时的温度为________℃。
(4)若在(3)所处的温度下,在1 L的密闭容器中,加入2 mol CO2和3 mol H2充分反应达平衡时,H2的物质的量为________。
a.等于1.0 mol b.大于1.0 mol c.大于0.5 mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学键的叙述中,正确的是( )
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.离子化合物中一定含有金属离子
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
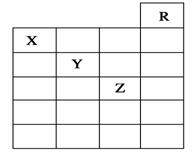
①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素
A.只有③ B.只有①④
C.只有①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种元素,元素A的一种原子无中子,元素B和C都有2个电子层,它们能生成无色无嗅的气体BC2,元素D有三个电子层,它和元素C属于同一主族,D和C生成有刺激性气味的气体DC2;元素E的阳离子E+的电子层结构与Ar的电子层结构相同,试回答:
(1)它们的元素符号是:
A B C D (2分每空)
(2)(3分)A和D的化合物与C和D的化合物(DC2)能否反应?若能反应写出反应方程式: ,
(3) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将铁片和银片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,下列叙述正确的
A.负极有Cl2逸出,正极有H2逸出 B.负极附近Cl-的浓度减小
C.正极附近Cl-的浓度逐渐增大 D.溶液中Cl-的浓度基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
下列有关说法正确的是
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.若将CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液中性,则溶液中
2 c (CO32ˉ)+ c (HCO3ˉ)= 0.1 mol·L-1
C.根据上表, 水解方程式ClOˉ+ H2O HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6
D.向上述NaClO 溶液中通HF气体至恰好完全反应时:
c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OHˉ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com