
| A、①② | B、①③ | C、②③ | D、①②③ |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、在多电子的原子里,能量高的电子通常在离核近的区域内运动 |
| B、核外电子总是先排在能量低的电子层里,例如一般先排满了L层后才排M层 |
| C、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| D、微粒的最外层只能是8个电子才稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O3在反应中被氧化为O2 |
| B、1molO3在反应中得到6mol电子 |
| C、KI在反应中被还原为I2 |
| D、KI在反应中被氧化为I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X占混合气体的体积分数不变 |
| B、单位时间生成a molX,同时生成3a molY |
| C、X、Y、Z的浓度不再变化 |
| D、X、Y、Z的分子数比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、气体甲可能是混合物 |
| B、沉淀甲是硅酸和硅酸镁的混合物 |
| C、白色沉淀乙的主要成分是氢氧化铝 |
| D、K+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);
③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);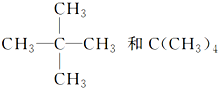
| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com