
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
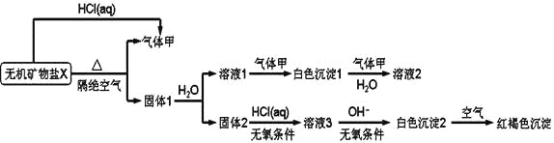
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,
写出气体甲的电子式________。
(2)X的化学式是____,在惰性气流中加热X至完全分解的化学方程式为_______________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________。
(用化学方程式表示)。
(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式____________________,并设计实验方案验证该反应的产物_________________________。
【答案】(1)![]() ;
;![]()
(2)CaFe(CO3)2;CaFe(CO3)2![]() CaO+FeO+2CO2↑
CaO+FeO+2CO2↑
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)2FeO+CO2![]() Fe2O3+CO;取适量固体于试管中,加入盐酸溶解,滴入几滴KSCN溶液,若溶液变红色,说明产物中含有三价铁。
Fe2O3+CO;取适量固体于试管中,加入盐酸溶解,滴入几滴KSCN溶液,若溶液变红色,说明产物中含有三价铁。
【解析】试题分析:X能和HCl反应生成气体甲,隔绝空气加热X得到气体甲和固体1,且X和HCl(aq)反应也能得到甲,因此猜测X是碳酸盐,因为X加热易分解且能和酸反应生成CO2,那么甲为CO2,固体1溶于水得到溶液1和固体2,溶液1和二氧化碳反应生成白色沉淀1,白色沉淀1和二氧化碳、水反应生成溶液2,则白色沉淀1为碳酸盐、溶液2为碳酸氢盐;固体2和稀盐酸反应生成溶液3,且需要无氧条件,溶液3中加入碱在无氧条件下生成白色沉淀2,白色沉淀2被空气氧化生成红褐色沉淀,则白色沉淀2是Fe(OH)2,溶液3为FeCl2,X仅含4种元素,碳酸盐分解生成二氧化碳气体和两种氧化物,其中一种氧化物能溶于水,结合地壳的成分猜测固体1中成分为CaO、FeO,对应地,X应为CaFe(CO3)2,结合题中信息:10.80gX在惰性气流中加热至完全分解,得到6.40g固体1,经计算,确认X为CaFe(CO3)2,那么,溶液1是Ca(OH)2,白色沉淀1是CaCO3,溶液2是Ca(HCO3)2。
(1)白色沉淀1是CaCO3,碳酸钙中金属元素的原子核外有4个电子层、最外层有2个电子,所以Ca原子结构示意图为![]() ,气体甲是二氧化碳,二氧化碳的电子式为
,气体甲是二氧化碳,二氧化碳的电子式为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)通过以上分析知,X的化学式是CaFe(CO3)2,在惰性气流中加热X至完全分解生成二氧化碳和氧化钙、氧化亚铁,所以该反应的化学反应方程式为CaFe(CO3)2![]() CaO+FeO+2CO2↑,故答案为:CaFe(CO3)2;CaFe(CO3)2
CaO+FeO+2CO2↑,故答案为:CaFe(CO3)2;CaFe(CO3)2![]() CaO+FeO+2CO2↑;
CaO+FeO+2CO2↑;
(3)氢氧化亚铁不稳定,易被空气氧化生成红褐色氢氧化铁,所以白色沉淀2在空气中变成红褐色沉淀,反应方程式为4Fe(OH)2+2H2O+O2=4Fe(OH)3,故答案为:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,氧化亚铁具有还原性,能被二氧化碳氧化生成四氧化三铁或氧化铁,同时生成CO,反应方程式为2FeO+CO2![]() Fe2O3+CO(或生成Fe3O4),如果该反应发生,则生成固体中含有三价铁,将固体溶于稀盐酸生成铁离子,铁离子和KSCN溶液反应生成血红色物质而使溶液变红色,故答案为:2FeO+CO2
Fe2O3+CO(或生成Fe3O4),如果该反应发生,则生成固体中含有三价铁,将固体溶于稀盐酸生成铁离子,铁离子和KSCN溶液反应生成血红色物质而使溶液变红色,故答案为:2FeO+CO2![]() Fe2O3+CO(或生成Fe3O4);取适量固体于试管中,加入盐酸溶解,滴入几滴KSCN溶液,若溶液变红色,说明产物中含有三价铁。
Fe2O3+CO(或生成Fe3O4);取适量固体于试管中,加入盐酸溶解,滴入几滴KSCN溶液,若溶液变红色,说明产物中含有三价铁。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为________________________________。
(3)电解E的水溶液时,E起到的作用是________________________。
(4)写出B+C—→D的化学方程式:_____________________________;
写出E+G—→F的离子方程式:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )

A.该反应的化学方程式为M═2N
B.若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1
C.t3时正反应速率等于逆反应速率
D.t2时正逆反应速率相等,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①0.001 mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B< D;
③E是弱电解质。回答下列问题:
(1)D是____________溶液,判断理由是______________________。
(2)用水稀释0.1 mol·L-1 B时,溶液中随着水量的增加而减小的是________(填写序号)。
①![]() ②
②![]() ③c(H+)和c(OH-)的乘积 ④OH-的物质的量
③c(H+)和c(OH-)的乘积 ④OH-的物质的量
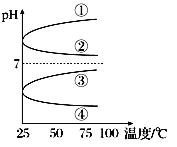
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的________曲线(填写序号)。
(4)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)我国《可再生能源法》倡导资源的高效转化及循环利用。下列做法错误的是
A.回收废旧电池,其主要目的是回收其中的金属
B.大力发展煤的气化及液化技术
C.用聚乙烯塑料代替聚乳酸塑料可减少白色污染
D.加快石油等化石燃料的开采和使用
E.以CO2为原料生产可降解塑料
F.将秸秆进行加工转化为乙醇燃料
(2)用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.NaCl B.H2SO4 C.CuCl2 D.AgNO3
(3)Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,石墨电极附近溶液的pH (填增大、减小、不变)

(4)一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ,经测定完全吸收燃烧后生成的二氧化碳气体需消耗5 mol·L-1的KOH溶液100 mL,且恰好生成正盐。则此条件下反应:C4H10(g)+![]() O2(g)=4CO2(g)+5H2O(l)的ΔH ﹦
O2(g)=4CO2(g)+5H2O(l)的ΔH ﹦
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相结合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中甲、乙、丙、丁均为石墨电极。

①若装置中通过0.5 mol e-,则理论上甲电极生成X气体的体积为__________L(标准状况下)
②图中NaOH溶液的质量分数a﹪、b﹪、c﹪由大到小的顺序为________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧层的破坏导致紫外线对地球表面辐射量的增加,从而使全球皮肤癌的发病人数明显增加。造成这一现象的主要原因是( )
A.人们大量使用氟氯烷烃
B.人们在炼钢时向空气中排放了大量的高炉煤气
C.石油炼制厂排放了大量的甲烷、氢气
D.硝酸、硫酸工厂排放了大量的二氧化硫和一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A.在500 mL容量瓶中配制500 mL烧碱溶液 |
B.用移液管(或碱式滴定管)量取50.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂 |
C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解 |
D.将物质的量浓度为c mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1mL |
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2mL 请完成下列问题:
(1)正确的操作步骤是(填写字母)________→________→________→D→________.
(2)滴定管读数应注意_______________________.
(3)操作中锥形瓶下垫一张白纸的作用是___________________.
(4)操作D中液面应调整到________________________;尖嘴部分应____________.
(5)滴定到终点时锥形瓶内溶液的pH约为___________;终点时的颜色变化是________.
(6)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响________(填“偏高”、“偏低”或“无影响”,其他操作均正确).
(7)该烧碱样品的纯度计算式是__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金与铁的物理性质的比较见下表:
熔点(℃) | 密度/(g·cm-3) | 硬度(金 刚石为10) | 导电性 (银为100) | |
某合金 | 2 500 | 3.00 | 7.4 | 2.3 |
铁 | 1 535 | 7.86 | 4.5 | 17 |
还知该合金耐腐蚀、强度大,从以上性能看,该合金不适合做( )
A. 导线 B. 门窗框
C. 炉具 D. 飞机外壳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com