
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是
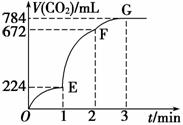
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.04 mol·L-1·min-1
C.OE、EF、FG三段中,该反应用二氧化碳 表示的平均反应速率之比为2∶6∶7
表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.通常说的三大合成材料是指塑料、合成纤维、合成橡胶
B.塑料的主要成分是合成树脂,另外还含有一些添加剂
C.用木材等经化学加工制成的黏胶纤维属于合成纤维
D.合成橡胶的原料是石油和煤
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:H(g) + H(g) = H2(g) ΔH=-435.7kJ/mol,此热化学方程式包含的意义是
A.氢原子的能量比氢分子的能量低
B.两个氢原子结合成一个氢分子时放出435.7kJ能量
C. 1mol氢分子分解成2mol氢原子要吸收435.7kJ能量
D. 2mol氢原子结合1mol氢分子成要吸收435.7kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
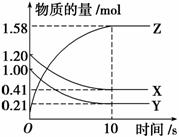
(1)从反应开始到10 s时,用Z表示的反应速率为_________________________________,
X的物质的量浓度减少了______,Y的转化率为__________________________________。
(2)该反应的化学方程式为______________________________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是________。
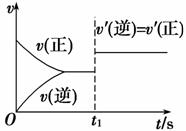
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g) 2H2(g)+O2(g) ΔH=484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是
A.前20 min内的反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
在开发利用金属矿物和海水资源过程中,下列说法不正确的是( )
A.工业上可用电解法冶炼得到金属铝
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水淡化的方法主要有蒸馏法、离子交换法等
D.海水中含有钾元素,需经过氧化还原反应才可得到钾单质
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上冶炼金属,常用的方法有四种:Ⅰ.热分解法,Ⅱ.热还原法,Ⅲ.电解法,Ⅳ .湿法冶金,下表中金属与常用冶炼方法相符的是( )
.湿法冶金,下表中金属与常用冶炼方法相符的是( )
| 金属 | 冶炼方法 | |
| A | 钾、钙 | Ⅳ |
| B | 钠、铝 | Ⅲ |
| C | 铜、铁 | Ⅰ |
| D | 银、汞 | Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体并微热,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目没有明显变化的是( )
A.Fe3+ B.Fe2+ C.NH4+ D.Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com