
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
| A、Na2O2晶体中阴阳离子个数之比为1:1 | B、Na2O2晶体中既有离子键又有非极性共价键 | C、Na2O2在空气中加热可以得到更稳定的Na2O | D、Na2O2长期露置于空气中最终转变成NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引个________Cl-,而Na+数目与Cl-数目之比为__________。
(2)Na+半径与Cl-半径之比![]() =__________。(已知
=__________。(已知![]() =1.414,
=1.414,![]() =1.732,
=1.732,![]() =2.236)
=2.236)
(3)NaCl晶体不存在分子,但在温度达到1 413 ℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1 450 ℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
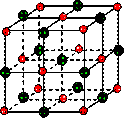
在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。
①在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有 个。
每个Na+离子周围与它最接近的、且距离相等的Na+共有 个。而Na+离子数目与Cl-离子数目之比为 。
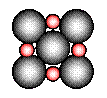
②在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。
![]()
|
a
(1) (2) (3)
③试回答下列问题:
NaCl晶体中离子键的键长为 。Na+离子半径与Cl-离子
半径比r+/r- = 。(已知 √2=1.414 , √3=1.732, √5=2.236)
④NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25gNaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式为 。
⑤纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分数为 。
查看答案和解析>>
科目:高中化学 来源:选修三物质结构与性质复习单元测试 题型:填空题
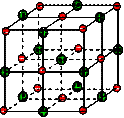
(16分)在离子晶体中,阴阳离子按一定规律在空间排列,如图(1)所示即是NaCl的晶体结构,这两种离子在空间三个互相垂直的方向上都是等距离排列的。 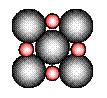
①在晶体中,每个Na+离子周围与它最接近的、且距离相等的Cl-共有 个。
每个Na+离子周围与它最接近的、且距离相等的Na+共有 个。而Na+离子数目与Cl-离子数目之比为 。
②在离子晶体中,阴阳离子具有球对称的电子云。它们可以被看成是不等径的刚性圆球,并彼此相切(如图⑵所示)。离子键的键长是相邻阴阳离子的半径之和(如图⑶所示),已知a为常数。
|
查看答案和解析>>
科目:高中化学 来源:09~10年黄冈中学高一下学期期末考试化学卷 题型:填空题
(10分)由阴阳离子通过离子键结合而成的晶体称为离子晶体,离子化合物固态时一般为晶体,在离子晶体中,阴、阳离子按一定规律在空间排列。下图是NaCl晶体的晶胞结构。(空心点为Cl—,实心球为Na+)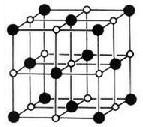
(1)在NaCl晶体中,每个Na+离子同时吸引着_______个Cl—离子,在周围与它最接近且等距离的Cl—共有___________个,Cl—离子位于Na+围成的___________体中心,而Na+离子数目与Cl-离子数目之比为___________。
(2)若CuO晶体中O2-采取NaCl晶胞结构中Na+的堆积方式,Cu2+占据O2-围成的正四面体空隙,则Cu2+占据O2-围成的正四面体空隙的占据率为 __________。
在离子晶体中,阴、阳离子具有或接近具有球形对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如下图),离子键的键长是相邻阴、阳离子的半径之和(如下图)。已知a为常数。试回答下列问题: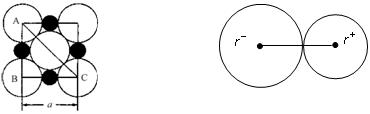
NaCl晶体中微粒间排布 NaCl晶体中离子键键长
(3)NaCl晶体离子键的键长为____________。
(4)Na+离子半径与Cl-离子半径之比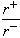 =_______________。
=_______________。
(已知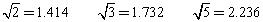 )
)
(5)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形成存在,现在29.25g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com