
【题目】判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。

(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸_________,亚砷酸________。
(2)亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式分别是:亚磷酸:_____,亚砷酸:______。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,写出化学方程式________________。
【答案】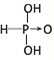
![]() H3PO3+2NaOH=Na2HPO3+2H2O H3AsO3+3NaOH=Na3AsO3+3H2O 亚磷酸是中强酸和盐酸不反应,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H2O
H3PO3+2NaOH=Na2HPO3+2H2O H3AsO3+3NaOH=Na3AsO3+3H2O 亚磷酸是中强酸和盐酸不反应,亚砷酸和盐酸能反应,反应方程式为As(OH)3+3HCl=AsCl3+3H2O
【解析】
(1)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式;
(2)酸和碱反应生成盐和水,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸。
(3) 亚磷酸为中强酸,不与盐酸反应,亚砷酸为两性物质,可与盐酸反应。
(1)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,所以亚磷酸和亚砷酸的结构式分别为: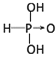 、
、![]() ,
,
综上所述,本题答案是: 、
、![]() 。
。
(2)酸和碱反应生成盐和水,亚磷酸中含有2个羟基,属于二元酸,亚砷酸属于三元酸,亚磷酸和氢氧化钠反应生成Na2HPO3,反应方程式为:H3PO3+2NaOH=Na2HPO3+2H2O;亚砷酸和氢氧化钠反应生成Na3AsO3,反应方程式为:H3AsO3+3NaOH=Na3AsO3+3H2O;
综上所述,本题答案为:H3PO3+2NaOH=Na2HPO3+2H2O、H3AsO3+3NaOH=Na3AsO3+3H2O。
(3) 亚磷酸为中强酸,不与盐酸反应,亚砷酸为两性物质,可与盐酸反应生成AsCl3和H2O,反应方程式为As(OH)3+3HCl=AsCl3+3H2O;
综上所述,本题答案是:亚磷酸是中强酸和盐酸不反应,亚砷酸和盐酸能反应,As(OH)3+3HCl=AsCl3+3H2O。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是

A. 简单离子的半径大小关系:B>C>E
B. C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故
C. 由A、B两种元素组成的离子化合物NH5中,阴、阳离子个数比为1:1
D. 由C、D、E三种元素组成的某种化合物,其水溶液能与盐酸反应产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为_____;
(2)9.5克某金属氯化物MCl2 中含有0.200molCl-,则该氯化物的摩尔质量为 ______________,金属M的相对原子质量为 ______________。
(3)同温同压时,某气体A对氢气的相对密度为22。则在标准状况下,气体A的密度为________g/L ,质量为4.4g的气体A所含有的分子数约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4(NH4)2SO4![]() N2↑+6NH3↑+3SO2↑+SO3↑+7H2O。将硫酸铵完全分解后的气体通入过量BaCl2溶液中,有白色沉淀生成且有无色无味气体逸出。说法正确的是
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O。将硫酸铵完全分解后的气体通入过量BaCl2溶液中,有白色沉淀生成且有无色无味气体逸出。说法正确的是
A. 生成沉淀中有BaSO4和BaSO3,且n(BaSO4):n(BaSO3)约为1:1
B. 生成沉淀中有BaSO4和BaSO3,且n(BaSO4):n(BaSO3)约为1:2
C. 生成沉淀中有BaSO4和BaSO3,且n(BaSO4):n(BaSO3)约为1:3
D. 从溶液中逸出的气体只有N2,溶液中溶质只有NH4Cl、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钒在元素周期表中的位置为__________,其价层电子排布图为____________。
(2)基态镓(Ga)原子的电子排布式:__________________。
(3) Fe3+的电子排布式为__________________。
(4)基态铜原子的核外电子排布式为__________________。
(5) Ni2+的价层电子排布图为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟侯氏制碱法原理,可以制备一些常见的化合物。
i. 30℃时,向饱和NaCl溶液中加入NH4HCO3细粉,制备NaHCO3晶体。
(1)已知30℃时几种盐的溶解度为:
物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
S(g/100gH2O) | 36.3 | 27.0 | 11.1 | 41.1 |
书写化学方程式_______________________。根据反应原理结合信息解释NaHCO3易析出的原因__________________________。

(2)过滤出NaHCO3晶体后,为继续分离滤液中的物质,设计如图装置。左侧发生装置可制取氨气,原因是_____________。一段时间后,试管中析出白色晶体为_______。用冰水浴降温目的是_____________。
ii. 制取(NH4)2SO4晶体的流程如下:

(3)“转化”步骤中CO2不宜过量,原因是__________________。
(4)操作I和II所需的实验步骤顺序是____________(选填编号,可重复选择)。
a. 蒸发浓缩 b. 蒸馏 c. 过滤 d. 萃取 e. 分液 f. 冷却结晶
(5)为测定某硫酸铵样品(杂质为碳酸铵)纯度。先准确称取5.000g样品溶于水,加入足量的_______,再加入足量BaCl2溶液充分反应后过滤、洗涤沉淀并烘干至恒重,最终所得固体为8.155g。则硫酸铵样品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H4)和 E(C3H4)是基本的有机化工原料。由 A 和 E 制备聚酰亚胺泡沫塑料(PMI)的合成路线如下:(部分反应条件略去)

已知:①RCH= CH2![]() RCH2CH2CHO
RCH2CH2CHO
②R1CHO+R2CH2CHO![]() (注:R1 可以是烃基,也可以是 H 原子)
(注:R1 可以是烃基,也可以是 H 原子)
③F 的核磁共振氢谱有两种化学环境的氢,其峰面积之比为 2∶3 回答下列问题:
(1)B 含有的官能团名称是____________; ⑥的反应类型是____________ ;
(2)C 与新制 Cu(OH)2 反应的化学方程式为_____________________________________;
(3)下列说法正确的是____________。
A.A(C2H4)和 E(C3H4)这两种基本的有机化工原料可通过石油裂解获得
B.1molF 最多可与 3molH2 发生加成反应
C.PMI 在碱性条件下加热能发生水解反应有刺激性气味的气体产生
D.A、B、C、D、E、F 六种物质均能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn、Fe及其化合物在生产生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:

(1)为了提高酸浸效率,可采用的措施有___________________________________(任答两条);
写出ZnFe2O4溶于酸的离子方程式____________________________________
(2)向净化Ⅰ操作中加入ZnO的目的___________________________________
(3)若净化后的溶液中Cu2+浓度为1×10-12mol/L,则净化后溶液中Zn2+浓度为__________(已知:室温下Ksp(ZnS)=1.6×10-24, Ksp(CuS)=6.4×10-36)
(4)“电解”工艺制锌时Zn2+利用率较低,废液中有大 量的Zn2+ 残留。某化工厂拟采用改变酸锌比净化废液的方式来提高原料的利用率,降低成本。如图是工业生产中不同酸锌比时净化液利用率对电解时直流电耗能影响关系图。根据图分析,该工厂净化废液时的最佳酸锌比为______。

A. 5:1 B.6:1 C.7:1 D.10:1
(5)ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为_______________________________________。测热分解后产品中ZnFe2O4的质量分数方法如下:取a克产品用H2SO4溶解后加入足量KI溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用c mol/L Na2S2O3标准溶液滴定,用去此标准溶液v mL时,刚好到达滴定终点,则此产品中ZnFe2O4的质量分数为____________(用a、c、v表示)。(已知:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com