
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石结构的一个晶胞. 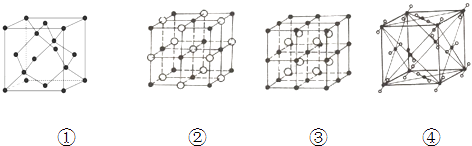
(1)其中代表金刚石的是(填编号字母,下同) , 其中每个碳原子与个碳原子最接近且距离相等.金刚石属于晶体.
(2)其中表示NaCl的是 , 每个Na+周围与它最接近且距离相等Na+有个,每个晶胞有个Na+ .
(3)代表CsCl的是 , 它属于晶体,每个Cs+与个Cl﹣紧邻.
(4)代表干冰的是 , 它属于晶体,每个CO2分子与个CO2分子紧邻,该晶胞中有个CO2分子.
(5)上述四种物质的熔点由高到低的排列顺序为(填物质名称) .
【答案】
(1)①;4;原子
(2)②;12;4
(3)③;离子;8
(4)④;分子;12;4
(5)金刚石>NaCl>CsCl>干冰
【解析】解:根据不同物质晶体的结构特点来辨别图形所代表的物质.(1)金刚石是原子晶体,构成微粒是原子,形成的是空间网状结构,故选①,其中每个碳原子与4个碳原子最接近且距离相等,金刚石属于原子晶体. 所以答案是:①;4;原子.(2)氯化钠是离子晶体,其构成微粒是阴阳离子,NaCl晶胞是简单的立方单元,阴阳离子间通过离子键结合,故选②,每个Na+周围与它最接近且距离相等Na+有12个,每个晶胞有12× ![]() +1=4个Na+ ,
+1=4个Na+ ,
所以答案是:②;12;4;(3)CsCl是由阴阳离子构成的,氯离子和铯离子的配位数是8,故选③,它属于离子晶体,每个Cs+与8个Cl﹣紧邻,所以答案是:③;离子;8;(4)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图④为干冰晶体,该晶胞中有 ![]() =4个CO2分子,
=4个CO2分子,
所以答案是:④;分子;12;4;(5)晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成正比,与电荷成正比,金刚石是原子晶体、NaCl和CsCl是离子晶体、干冰是分子晶体,钠离子半径小于铯离子半径,所以这几种晶体熔点高低顺序是金刚石>NaCl>CsCl>干冰.
所以答案是:金刚石>NaCl>CsCl>干冰.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃的混合物共10g,平均相对分子质量为25.使混合气通过足量溴水,溴水增重8.4g,则混合气中的烃分别是( )
A.甲烷和乙烯
B.甲烷和丙烯
C.乙烷和乙烯
D.乙烷和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种方法中:①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④在金属表面进行电镀⑤使金属表面形成致密的氧化物薄膜,能对金属起到防护或减缓腐蚀作用的是 ( )
A.①②③④
B.①③④⑤
C.①②④⑤
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.金属的电化学腐蚀比化学腐蚀普遍
B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.原电池中电子经外电路由负极流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】口服含13C 的尿素胶囊,若胃部存在幽门螺杆菌,尿素会被水解形成13CO2,医学上通过检测呼出气体是否含13CO2,间接判断是否感染幽门螺杆菌,下列有关说法正确的是( )
A.13CO2和12CO2互称同位素B.13C原子核外有2个未成对电子
C.尿素属于铵态氮肥D.13C的质量数为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验: 
(1)装置A的圆底烧瓶中发生反应的化学方程式为 , 为保持装置C为无水环境,装置B中加入的试剂是 .
(2)实验步骤:如图连接装置后,先(填实验操作),再装药品,然后点燃(填“A”或“C”)处酒精灯,当(填实验现象)时,再点然(填“A”或“C”)处酒精灯.
(3)装置D的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略).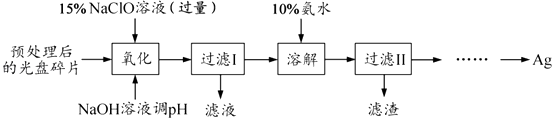
已知:①NaClO溶液在受热或酸性条件下易分解,如 3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水 AgCl+2NH3H2OAg(NH3)2++Cl﹣+2H2O
③常温时 N2H4H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:
4Ag(NH3)2++N2H4H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 .
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 , 该反应的化学方程式为 . HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是 .
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并 .
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3H2O反应外(该条件下NaClO3与NH3H2O不反应),还因为 .
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:(实验中须使用的试剂有:2molL﹣1水合肼溶液,1molL﹣1H2SO4 ).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在任何分子中都含有化学键
B. 形成离子键的阴阳离子间只存在静电吸引力
C. CO2、PCl3分子中所有原子都满足最外层8电子稳定结构
D. D2O与H2O所含电子总数不相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com