
【题目】(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略).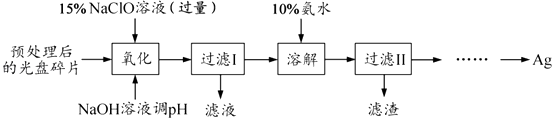
已知:①NaClO溶液在受热或酸性条件下易分解,如 3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水 AgCl+2NH3H2OAg(NH3)2++Cl﹣+2H2O
③常温时 N2H4H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:
4Ag(NH3)2++N2H4H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 .
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 , 该反应的化学方程式为 . HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是 .
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并 .
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3H2O反应外(该条件下NaClO3与NH3H2O不反应),还因为 .
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:(实验中须使用的试剂有:2molL﹣1水合肼溶液,1molL﹣1H2SO4 ).
【答案】
(1)水浴加热
(2)4Ag+4NaClO+2H2O═4AgCl+4NaOH+O2↑;会释放出氮氧化物(或NO、NO2),造成环境污染
(3)将洗涤后的滤液合并入过滤Ⅱ的滤液中
(4)未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl﹣ , 不利于AgCl与氨水反应
(5)向滤液中滴加2mol?L﹣1水合肼溶液,搅拌使其充分反应,同时用1mol?L﹣1H2SO4溶液吸收反应中放出的NH3 , 待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥
【解析】解:(1)“氧化”阶段需在 80℃条件下进行,不超过水的沸点,则适宜的加热方式为水浴加热,
所以答案是:水浴加热;(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 , Ag、O元素的化合价升高,Cl元素的化合价降低,由电子、原子守恒可知该反应的化学方程式为4Ag+4NaClO+2H2O═4AgCl+4NaOH+O2↑. HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是会释放出氮氧化物(或 NO、NO2 ),造成环境污染,
所以答案是:4Ag+4NaClO+2H2O═4AgCl+4NaOH+O2↑;会释放出氮氧化物(或 NO、NO2 ),造成环境污染;(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤后的滤液合并入过滤Ⅱ的滤液中,减少Ag的损失,
所以答案是:将洗涤后的滤液合并入过滤Ⅱ的滤液中;(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3H2O反应外(该条件下NaClO3与NH3H2O不反应),还因为未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl﹣ , 不利于AgCl与氨水反应,
所以答案是:未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl﹣ , 不利于AgCl与氨水反应;(5)由信息③可知,从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案为向滤液中滴加2molL﹣1水合肼溶液,搅拌使其充分反应,同时用1 molL﹣1 H2SO4溶液吸收反应中放出的NH3 , 待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥,
所以答案是:向滤液中滴加2molL﹣1水合肼溶液,搅拌使其充分反应,同时用1 molL﹣1 H2SO4溶液吸收反应中放出的NH3 , 待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石结构的一个晶胞. 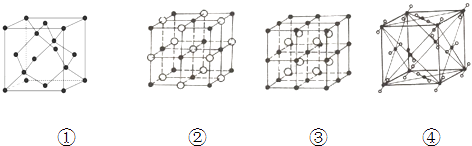
(1)其中代表金刚石的是(填编号字母,下同) , 其中每个碳原子与个碳原子最接近且距离相等.金刚石属于晶体.
(2)其中表示NaCl的是 , 每个Na+周围与它最接近且距离相等Na+有个,每个晶胞有个Na+ .
(3)代表CsCl的是 , 它属于晶体,每个Cs+与个Cl﹣紧邻.
(4)代表干冰的是 , 它属于晶体,每个CO2分子与个CO2分子紧邻,该晶胞中有个CO2分子.
(5)上述四种物质的熔点由高到低的排列顺序为(填物质名称) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)碱式氯化铜是重要的无机杀菌剂.
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl23H2O,该反应的化学方程式为 .
②方法2:先制得CuCl2 , 再与石灰乳反应生成碱式氯化铜.Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2 , Fe3+对该反应有催化作用,其催化原理如图所示. M′的化学式为 . 
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClcxH2O. 为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g;
③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000molL﹣1的EDTA(Na2H2Y2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( ) 
A.OA段产生的是NO和H2的混合气
B.BC段产生的全部是NO
C.Fe2(SO4)3是最终的溶质
D.H2SO4的物质的量浓度是2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.使用食品添加剂以后营养更丰富
B.天然食品添加剂比化学合成品安全可靠
C.食品添加剂的作用仅仅是为了好看
D.在食品包装的标签配料表上应注明食品添加剂的名称
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某铬矿石(主要成分是Cr2O3 , 含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下: 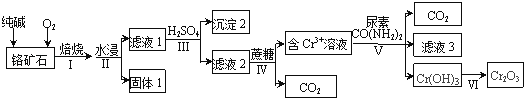
已知:Cr2O72﹣+H2O2CrO42﹣+2H+ , Ksp[Cr(OH)3]=6.4×10﹣31 , lg2=0.3
(1)步骤Ⅰ中为了提高反应速率应该采取的措施有、 . (写2种)
(2)滤液1中的阴离子除CO32﹣外,主要还有、 .
(3)步骤Ⅳ发生的反应中Cr2O72﹣和蔗糖(C12H22O11)的物质的量之比为 .
(4)步骤Ⅴ中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10﹣5molL﹣1],pH至少调至 .
(5)滤液3的主要溶质是两种盐,化学式为 .
(6)研究发现,固态Na2CrO4与氨气在500℃下反应得到NaCrO2 , 将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3 . 则NaCrO2溶液与过量CO2反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com