
【题目】(12分)碱式氯化铜是重要的无机杀菌剂.
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl23H2O,该反应的化学方程式为 .
②方法2:先制得CuCl2 , 再与石灰乳反应生成碱式氯化铜.Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2 , Fe3+对该反应有催化作用,其催化原理如图所示. M′的化学式为 . 
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClcxH2O. 为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g;
③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000molL﹣1的EDTA(Na2H2Y2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式(写出计算过程).
【答案】
(1)4CuCl+O2+8H2O ![]() 2Cu2(OH)2Cl2?3H2O;Fe2+
2Cu2(OH)2Cl2?3H2O;Fe2+
(2)
n(Cl﹣)=n(AgCl)× ![]() =
= ![]() =4.800×10﹣3mol,
=4.800×10﹣3mol,
n(Cu2+)=n(EDTA)× ![]() =0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1×
=0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1× ![]() =9.600×10﹣3 mol,
=9.600×10﹣3 mol,
n(OH﹣)=2n(Cu2+)﹣n(Cl﹣)=2×9.600×10﹣3 mol﹣4.800×10﹣3 mol=1.440×10﹣2 mol,
m(Cl﹣)=4.800×10﹣3 mol×35.5 gmol﹣1=0.1704 g,
m(Cu2+)=9.600×10﹣3 mol×64 gmol﹣1=0.6144 g,
m(OH﹣)=1.440×10﹣2 mol×17 gmol﹣1=0.2448 g,
n(H2O)= ![]() =4.800×10﹣3 mol,
=4.800×10﹣3 mol,
则a:b:c:x=n(Cu2+):n(OH﹣):n(Cl﹣):n(H2O)=2:3:1:1,
即化学式为Cu2 (OH)3ClH2O,
答:该样品的化学式为Cu2 (OH)3ClH2O.
【解析】解:(1)①45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl23H2O,反应物为CuCl、氧气、水,Cu元素的化合价升高,O元素的化合价降低,由原子、电子守恒可知反应为4CuCl+O2+8H2O ![]() 2Cu2(OH)2Cl23H2O,
2Cu2(OH)2Cl23H2O,
所以答案是:4CuCl+O2+8H2O ![]() 2Cu2(OH)2Cl23H2O;
2Cu2(OH)2Cl23H2O;
②Fe3+对该反应有催化作用,结合图可知,Cu元素的化合价升高,则M中Fe元素的化合价降低,可知M′的化学式为Fe2+ ,
所以答案是:Fe2+;(2)n(Cl﹣)=n(AgCl)× ![]() =
= ![]() =4.800×10﹣3mol,
=4.800×10﹣3mol,
n(Cu2+)=n(EDTA)× ![]() =0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1×
=0.08000 molL﹣1×30.00 mL×10﹣3 LmL﹣1× ![]() =9.600×10﹣3 mol,
=9.600×10﹣3 mol,
n(OH﹣)=2n(Cu2+)﹣n(Cl﹣)=2×9.600×10﹣3 mol﹣4.800×10﹣3 mol=1.440×10﹣2 mol,
m(Cl﹣)=4.800×10﹣3 mol×35.5 gmol﹣1=0.1704 g,
m(Cu2+)=9.600×10﹣3 mol×64 gmol﹣1=0.6144 g,
m(OH﹣)=1.440×10﹣2 mol×17 gmol﹣1=0.2448 g,
n(H2O)= ![]() =4.800×10﹣3 mol,
=4.800×10﹣3 mol,
则a:b:c:x=n(Cu2+):n(OHspan>﹣):n(Cl﹣):n(H2O)=2:3:1:1,
即化学式为Cu2 (OH)3ClH2O,
答:该样品的化学式为Cu2 (OH)3ClH2O.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶质的质量分数为 b%;浓度不等的两种氨水等质量混合后,溶液的质量分数为a%,而等体积混合后,溶质的质量分数为c%,那么,a、b、c数值的关系是( )
A.b>a>c
B.c>a>b
C.c>b>a
D.a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.金属的电化学腐蚀比化学腐蚀普遍
B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀
D.原电池中电子经外电路由负极流向正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水.现模拟该过程用图示装置进行实验: 
(1)装置A的圆底烧瓶中发生反应的化学方程式为 , 为保持装置C为无水环境,装置B中加入的试剂是 .
(2)实验步骤:如图连接装置后,先(填实验操作),再装药品,然后点燃(填“A”或“C”)处酒精灯,当(填实验现象)时,再点然(填“A”或“C”)处酒精灯.
(3)装置D的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含 量过低,对实验的影响可忽略).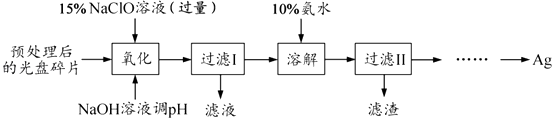
已知:①NaClO溶液在受热或酸性条件下易分解,如 3NaClO═2NaCl+NaClO3
②AgCl可溶于氨水 AgCl+2NH3H2OAg(NH3)2++Cl﹣+2H2O
③常温时 N2H4H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:
4Ag(NH3)2++N2H4H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 .
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 , 该反应的化学方程式为 . HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是 .
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并 .
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3H2O反应外(该条件下NaClO3与NH3H2O不反应),还因为 .
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:(实验中须使用的试剂有:2molL﹣1水合肼溶液,1molL﹣1H2SO4 ).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.油脂发生皂化反应能生成甘油
B.乙炔、丙烯酸(CH2=CHCOOH)、醋酸乙烯酯(CH3COOCH=CH2)均可作为合成聚合物的单体
C.蔗糖及其水解产物均能与新制氢氧化铜反应生成红色沉淀
D.谷氨酸分子( ![]() )缩合最多可形成2种二肽(不考虑立体异构)
)缩合最多可形成2种二肽(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10molL﹣1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、 , 制得等量H2所需能量较少的是 .
(3)H2S与CO2在高温下发反应:生H2S(g)+CO2(g)COS(g)+H2O(g).在610k时,将0.10mol CO2与0.40mol H2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
①H2S的平衡转化率a1=%,反应平衡常数K= .
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率a2a1 , 该反应的△H0.(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)
A.H2S B.CO2 C.COS D.N2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的反应热为可燃物的燃烧热的是[ ]
A.H2(g)+1/2O2(g)=H2O(g) △H =-241.8kJ·mol—1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =-846.3kJ·mol—1
C.C(s)+O2(g)=CO2(g) △H =-393.5kJ·mol—1
D.C3H8(g)+5O2(g)=3CO(g)+4H2O(l)△ H = -2044.0kJ·mol—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com