
【题目】(14分)近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10molL﹣1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为、 , 制得等量H2所需能量较少的是 .
(3)H2S与CO2在高温下发反应:生H2S(g)+CO2(g)COS(g)+H2O(g).在610k时,将0.10mol CO2与0.40mol H2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
①H2S的平衡转化率a1=%,反应平衡常数K= .
②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率a2a1 , 该反应的△H0.(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)
A.H2S B.CO2 C.COS D.N2 .
【答案】
(1)D
(2)H2O(l)=H2(g)+ ![]() O2(g)△H=+286kJ/mol;H2S (g)=H2(g)+S(s)△H=+20kJ/mol;系统(Ⅱ)
O2(g)△H=+286kJ/mol;H2S (g)=H2(g)+S(s)△H=+20kJ/mol;系统(Ⅱ)
(3)2.5;0.00285;>;>;B
【解析】(1)A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以,符合强酸制备弱酸的特点,可说明亚硫酸的酸性比氢硫酸强,故A正确;
B.氢硫酸的导电能力低于相同浓度的亚硫酸,可说明亚硫酸的电离程度大,则亚硫酸的酸性强,故B正确;
C.0.10molL﹣1的氢硫酸和亚硫酸的pH分别为4.5和2.1,可说明亚硫酸的电离程度大,酸性较强,故C正确;
D.氢硫酸的还原性强于亚硫酸,不能用于比较酸性的强弱,故D错误.
所以答案是:D;(2)系统(Ⅰ)涉及水的分解,系统(Ⅱ)涉及硫化氢的分解,利用盖斯定律分别将系统(Ⅰ)和系统(Ⅱ)的热化学方程式相加,可得到水、硫化氢分解的热化学方程式,则系统(I)的热化学方程式H2O(l)=H2(g)+ ![]() O2(g)△H=+286kJ/mol;
O2(g)△H=+286kJ/mol;
系统(II)的热化学方程式可知:H2S (g)+=H2(g)+S(s)△H=+20kJ/mol.
根据系统I、系统II的热化学方程式每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II.
所以答案是:H2O(l)=H2(g)+ ![]() O2(g)△H=+286kJ/mol;H2S (g)+=H2(g)+S(s)△H=+20kJ/mol;系统(Ⅱ);(3)对于反应
O2(g)△H=+286kJ/mol;H2S (g)+=H2(g)+S(s)△H=+20kJ/mol;系统(Ⅱ);(3)对于反应
H2S(g)+ | CO2(g) | COS(g)+ | H2O(g) | |
起始(mol) | 0.40 | 0.10 | 0 | 0 |
转化(mol) | x | x | x | x |
平衡(mol) | 0.40-x | 0.10-x | x | x |
反应平衡后水的物质的量分数为0.02,
则 ![]() =0.02,x=0.01,
=0.02,x=0.01,
①H2S的平衡转化率a1= ![]() =2.5%,
=2.5%,
体积为2.5L,则平衡时各物质的浓度为c(H2S)= ![]() mol/L=0.156mol/L,c(CO2)=
mol/L=0.156mol/L,c(CO2)= ![]() mol/L=0.036mol/L,c(COS)=c(H2O)=
mol/L=0.036mol/L,c(COS)=c(H2O)= ![]() mol/L=0.004mol.L,
mol/L=0.004mol.L,
则K= ![]() =0.00285,
=0.00285,
所以答案是:2.5;0.00285;
②根据题目提供的数据可知温度由610K升高到620K时,化学反应达到平衡,水的物质的量分数由0.02变为0.03,所以H2S的转化率增大,a2>a1;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故△H>0,
所以答案是:>;>;
③A.增大H2S的浓度,平衡正向移动,但加入量远远大于平衡移动转化消耗量,所以H2S转化率降低,故A错误;
B.增大CO2的浓度,平衡正向移动,使更多的H2S反应,所以H2S转化率增大,故B正确;
C.COS是生成物,增大生成物的浓度,平衡逆向移动,H2S转化率降低,故C错误;
D.N2是与反应体系无关的气体,充入N2 , 不能使化学平衡发生移动,所以对H2S转化率无影响,故D错误.
所以答案是:B.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.水的摩尔质量是18 gmol﹣1
B.硫离子的结构示意图: ![]()
C.8个质子、10个中子的原子: ![]() O
O
D.四氯化硅中Si的化合价为﹣4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)碱式氯化铜是重要的无机杀菌剂.
(1)碱式氯化铜有多种制备方法
①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl23H2O,该反应的化学方程式为 .
②方法2:先制得CuCl2 , 再与石灰乳反应生成碱式氯化铜.Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2 , Fe3+对该反应有催化作用,其催化原理如图所示. M′的化学式为 . 
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClcxH2O. 为测定某碱式氯化铜的组成,进行下列实验:
①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g;
③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000molL﹣1的EDTA(Na2H2Y2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL.通过计算确定该样品的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向200mL稀硫酸和稀硝酸的混合溶液中逐渐加入铁粉至过量,产生气体的量随铁粉质量增加的变化如图所示(假定硝酸只被还原为NO).则下列说法中,正确的是( ) 
A.OA段产生的是NO和H2的混合气
B.BC段产生的全部是NO
C.Fe2(SO4)3是最终的溶质
D.H2SO4的物质的量浓度是2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家不久前成功合成了3mm长的管状定向碳纳米管,长度居世界之首,这种碳纤维具有强度高、硬度(抵抗变形能力)高、密度小(只有钢的 ![]() )、熔点高、化学稳定性好等特点,因而被称为“超级纤维”.对碳纤维的下列说法中不正确的是( )
)、熔点高、化学稳定性好等特点,因而被称为“超级纤维”.对碳纤维的下列说法中不正确的是( )
A.它是制造飞机的理想材料
B.它是一种新的碳单质
C.它的结构与石墨相似
D.碳纤维复合材料不易导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.使用食品添加剂以后营养更丰富
B.天然食品添加剂比化学合成品安全可靠
C.食品添加剂的作用仅仅是为了好看
D.在食品包装的标签配料表上应注明食品添加剂的名称
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用实验室制得的乙烯(C2H5OH ![]() CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是( )
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是( ) 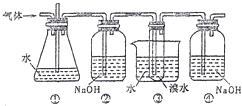
A.装置①和装置③中都盛有水,其作用相同
B.装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C.产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出
D.制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1 )称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: |
(2 )将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2 )A的分子式为: . |
(3 )另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3 )该有机物分子中含有羟基、羧 |
(4 )A的核磁共振氢谱如图: | (4 )A中含有种氢原子. |
(5 )综上所述,A的结构简式 , | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com