
生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2 等)与H2混合,催化合成甲醇和二甲醚(CH3OCH3)及许多烃类物质等,是生物质能利用的方法之一.
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:

反应:CO(g)+H2O(g)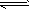 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
(2)甲醇是一种重要的能源和化工原料,工业上合成甲醇的反应为:CO+2H2⇌CH3OH.现已知:H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8KJ/mol、-283.0KJ/mol和-726.5KJ/mol。则:CH3OH不完全燃烧生成CO和液态H2O的热化学反应方程式 .
(3)在一定温度、压强和催化条件下,工业上用CO和H2反应生成二甲醚,同时产生一种参与大气循环的无机物。则该反应的化学反应方程式为: .
(4)下图左为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极上发生反应的电极反应式为 .
(5)连接下图右装置的电源为(4)问中的二甲醚燃料电池。接通电源一段时间后,观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。则该装置中的Cu电极应与二甲醚燃料电池中 电极(填a或b)相连。通电时发生反应的总的离子反应方程式为: .
(1)<; 0.36 (2)CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5KJ/mol
(3)3CO+3H2 =(CH3)2O+CO2或者2CO+4H2 =(CH3)2O+ H2O,
(4)(CH3)2O-12e-+3H2O=2CO2+12H+(5)b Cu+2H+ Cu2++H2↑
Cu2++H2↑
【解析】
试题分析:K1={ C(CO)·C(H2)} /C(H2O);K2=
{ C(CO2)·C2(H2)} /C2(H2O)
②-①整理得:CO(g)+H2O(g)  CO2(g)+H2(g),它的平衡常数为:K={ C(CO2)·C(H2)} /{
C(CO) ·C(H2O)}.=K2/K1. K越大,lgK就越大。升高温度K减小,说明升高温度化学平衡向逆反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应。所以正反应为放热反应。所以△H<0.在900K时,该反应平衡常数的对数值lgK =lgK2/K1=lgK2-lgK1=-0.03+0.39=0.36. (2)由题意可写出CO、CH3OH燃烧的热化学方程式①CO(g)+(1/2)O2(g)=CO2(g)
△H=-283.0KJ/mol;②CH3OH(l)+(3/2)O2(g)=CO2(g)+2H2O. ②-①得:CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5KJ/mol。(3)根据题意可得反应的化学方程式:3CO+3H2 =(CH3)2O+CO2或者2CO+4H2 =(CH3)2O+
H2O。(4)在燃料电池中,通入燃料的电极作负极,通入氧气的电极作正极。a电极及负极上发生反应的电极反应式是:(CH3)2O-12e-+3H2O=2CO2+12H+。(5)在电解池中观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。说明Cu失去了电子。Cu电极作阳极。二甲醚燃料电池中b电极(即正极)相连。通电时发生反应的总的离子反应方程式为:Cu+2H+
CO2(g)+H2(g),它的平衡常数为:K={ C(CO2)·C(H2)} /{
C(CO) ·C(H2O)}.=K2/K1. K越大,lgK就越大。升高温度K减小,说明升高温度化学平衡向逆反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应是吸热反应。所以正反应为放热反应。所以△H<0.在900K时,该反应平衡常数的对数值lgK =lgK2/K1=lgK2-lgK1=-0.03+0.39=0.36. (2)由题意可写出CO、CH3OH燃烧的热化学方程式①CO(g)+(1/2)O2(g)=CO2(g)
△H=-283.0KJ/mol;②CH3OH(l)+(3/2)O2(g)=CO2(g)+2H2O. ②-①得:CH3OH(l)+O2(g)=CO(g)+2H2O(l);△H=-443.5KJ/mol。(3)根据题意可得反应的化学方程式:3CO+3H2 =(CH3)2O+CO2或者2CO+4H2 =(CH3)2O+
H2O。(4)在燃料电池中,通入燃料的电极作负极,通入氧气的电极作正极。a电极及负极上发生反应的电极反应式是:(CH3)2O-12e-+3H2O=2CO2+12H+。(5)在电解池中观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。说明Cu失去了电子。Cu电极作阳极。二甲醚燃料电池中b电极(即正极)相连。通电时发生反应的总的离子反应方程式为:Cu+2H+ Cu2++H2↑。
Cu2++H2↑。
考点:考查原电池、电解池的反应原理及化学平衡常数的计算、热化学方程式的书写等知识。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省德阳市“一诊”考试化学试卷(解析版) 题型:填空题
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,
其晶体属于六方最密堆积,它的配位数是 。
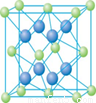
(4) Cu的一种氯化物晶体的晶胞结构如图所示。(空心球代表氯离子),则一个晶胞中所含的数目是 。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二10月阶段性考试化学试卷(解析版) 题型:填空题
(5分)生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2 等)与 H2 混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有 Cu、Zn、Al 等元素。写出基态 Cu2+离子的核外电子排布式_______________________________________;
(2)根据等电子原理,写出 CO 分子的结构式______________________;
(3)甲醇催化氧化可得到甲醛,甲醛与新制 Cu(OH)2 的碱性溶液反应生成 Cu2O 沉淀。
①甲醛分子中碳原子轨道的杂化类型为_____________________;
②甲醛分子的空间构型是__________________;
③ 1 mol 甲醛分子中 σ 键的数目为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com