
����Ŀ���Ȼ����Ǻϳ������ȣ�SO2Cl2���ij��÷�����ʵ���Һϳ������ȣ�SO2Cl2���ķ�Ӧ��ʵ��װ�����£�
SO2(g)��Cl2(g) ![]() SO2Cl2(l) ��H��- 92.7 kJ/mol
SO2Cl2(l) ��H��- 92.7 kJ/mol

�й���Ϣ���£�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ��54.1 �棬�е�Ϊ69.1 �棬�ܶ�Ϊ1.67g /cm3���ڳ�ʪ����������������100�����Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ᷢ���ֽ⡣�ش��������⣺
��1��װ�ü�������A������Ϊ___________�����л���̿��������________��B������Ϊ_________��
��2��װ�ö��з�����Ӧ�����ӷ���ʽΪ__________________________��
��3��װ�ñ��е��Լ�Ϊ____________________����ȱ��װ���ң������Ͷ���������ܷ�����Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��4��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������_______������ţ���
����ͨ����ˮ����ͨ�� �ڿ����������ʣ��������˿�
����������ƿ���̣����ʵ����� �ܼ���������ƿ
��5����ʵ����ͨ��SO2�����Ϊ11.2 L��������ɱ�״������Cl2���㣬ʵ�������ռ���������27.0 mL���������ȵIJ���Ϊ_________________���������һλС������
���𰸡������ܣ����������ܻ��������ܣ� ���� ��ֹˮ�������룬����β�� Cl+ClO+2H+��Cl2��+H2O ����ʳ��ˮ�����Ȼ�����Һ�� SO2+Cl2+2H2O��H2SO4+2HCl �٢ڢ� 66.8%
��������
��1�����������ص㣬װ�ü�������A������Ϊ���������ܻ��������ܣ�����̿���Ƿ�Ӧ�����������B�еļ�ʯ�ҿɷ�ֹ�����е�ˮ��������װ�ã������Է�ֹ�ж�����������������β��������
��2��װ�ö�������Ư�������ᷴӦ��ȡ������
��3��װ�ñ�Ϊ��ȥ�����е�HCl���壻װ���ҵ��Լ�ΪŨ���ᣬ�ɷ�ֹˮ��������װ�ü��У�����SO2Cl2�ڳ�ʪ����������������
��4������ͨ����ˮ����ͨ�����ɼ���SO2Cl2�Ļӷ���
�ڿ����������ʣ��������˿죬��ʹ��Ӧ��ֽ��У�
��100������SO2Cl2��ʼ�ֽ⣬���ɶ����������������������ƿ���̣����ʵ����£��ɼ���SO2Cl2�ķֽ⣻
�ܼ���������ƿ���ֽ��������ʽ��ͣ�
��5������n(SO2):n(SO2Cl2)=1��1��ת����=![]() ��100%���м��㡣
��100%���м��㡣
��1�����������ص㣬װ�ü�������A������Ϊ���������ܻ��������ܣ�����̿���Ƿ�Ӧ�����������B�еļ�ʯ�ҿɷ�ֹ�����е�ˮ��������װ�ã������Է�ֹ�ж�����������������β��������
��2��װ�ö�������Ư�������ᷴӦ��ȡ��������Ӧ�����ӷ���ʽΪCl+ClO+2H+��Cl2��+H2O��
��3��װ�ñ�Ϊ��ȥ�����е�HCl���壬ʹ�õ��Լ�Ϊ����ʳ��ˮ��װ���ҵ��Լ�ΪŨ���ᣬ�ɷ�ֹˮ��������װ�ü��У�����SO2Cl2�ڳ�ʪ������������������Ӧ�ķ���ʽΪSO2+Cl2+2H2O��H2SO4+2HCl��
��4������ͨ����ˮ����ͨ�����ɼ���SO2Cl2�Ļӷ����Ӷ���߲��ʣ��������⣬����ȷ��
�ڿ����������ʣ��������˿죬��ʹ��Ӧ��ֽ��У��Ӷ���߲��ʣ��������⣬����ȷ��
��100������SO2Cl2��ʼ�ֽ⣬���ɶ����������������������ƿ���̣����ʵ����£��ɼ���SO2Cl2�ķֽ⣬�Ӷ���߲��ʣ��������⣬����ȷ��
�ܼ���������ƿ���ֽ��������ʽ��ͣ������ⲻ�����ܴ���
��Ϊ�٢ڢۣ�
��5�����ݷ���ʽSO2(g)��Cl2(g) ![]() SO2Cl2(l)��n(SO2):n(SO2Cl2)=1��1��m(SO2Cl2)=1.67g /cm3��27.0 mL=45.09g��n(SO2Cl2)=
SO2Cl2(l)��n(SO2):n(SO2Cl2)=1��1��m(SO2Cl2)=1.67g /cm3��27.0 mL=45.09g��n(SO2Cl2)=![]() =0.334mol����Ӧ��n(SO2) =0.334mol��ת����=
=0.334mol����Ӧ��n(SO2) =0.334mol��ת����=![]() ��100%=66.8%��
��100%=66.8%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������CO2���������ӻ�Ӿ�����ЧӦ��Ϊ�������ŷţ��轫��ҵ�����в�����CO2����������д�������á�
��1��CO2��NH3��Ӧ�ɺϳɻ�������[��ѧʽΪCO(NH2)2]����Ӧ2NH3(g)��CO2(g)![]() CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ1��������������������Ϊ�ϳ����а���ͬ��̼��[
CO(NH2)2(l)��H2O(g)�ںϳ����н��С���ͼ1��������������������Ϊ�ϳ����а���ͬ��̼��[![]() ]��ˮ̼��[
]��ˮ̼��[![]() ]Ͷ��ʱ������̼ת���ʵ������
]Ͷ��ʱ������̼ת���ʵ������
����������������ˮ̼�ȵ���ֵ��Χ�ֱ�Ϊ0.6��0.7��1��1.1��1.5��1.61����������Ӧѡ��ˮ̼�ȵ���ֵ��ΧΪ_________________��
�����Ʋ������а�̼�ȿ�����4.0���һ��ǿ�����4.5���ұȽ����ˣ��������������__________________��

��2��CO2��H2Ҳ�����ںϳɼ״���CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ������У��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ2��ʾ��
CH3OH(g)+H2O(g)��������ɱ�ĺ�ѹ�ܱ������У��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ƽ��ת������ͼ2��ʾ��
���÷�Ӧ�Ļ�ѧƽ�ⳣ���ı���ʽΪ_______________________��
���÷�Ӧ����S___0
����֪�� �� CO(g)+2H2(g) CH3OH(g) ��H= -90.1 kJ��mol-1 ��CO(g) +H2O(g) CO2(g)+H2(g) ��H= -41.1 kJ��mol-1,��CO2��H2��Ӧ�ϳ�CH3OH(g)���Ȼ�ѧ����ʽΪ___________________��
��700KͶ�ϱ�[![]() ]=2ʱ��H2��ƽ��ת����Ϊ______________��
]=2ʱ��H2��ƽ��ת����Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. FeCl3��Һ������ͭ��ӡˢ��·����������÷�Ӧ���û���Ӧ
B. ����Һ�еμӴ��ᣬ�����ɵ�����ͨ�����ı�������Һ�У��۲��Ƿ���ֳ������ɴ�֤�����ᡢ̼�ᡢ��������ǿ��
C. ��ӦA(g)![]() B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol������H=-(Ea-Eb)kJ/mol
B(g) ��H��������Ӧ�Ļ��ΪEakJ/mol���淴Ӧ�Ļ��ΪEbkJ/mol������H=-(Ea-Eb)kJ/mol
D. 3x%��A���ʵ���Һ��x%��A���ʵ���Һ�������Ϻ���Һ����������С��2x%����A���ʿ���Ϊ�Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������״����Ͻ�TiNi�����㷺�����������Ǻ�����ɴ������ߣ����ٴ�ҽ��������Ҳ���й㷺��Ӧ�á��ش��������⣺
(1)д����̬Tiԭ�ӵĵ����Ų�ʽ:_________��Ni��Ԫ�����ڱ��е�λ����_________��
(2)�����Ͻ��������ȵ���������Ti(SO4)2��NiSO4�����������ӵ����幹��Ϊ______������ԭ�ӵĹ���ӻ�������_______��
(3)����ͬ���ڵ���һ��Ԫ����(Co)���γɷ���ʽ��ΪCo(NH3)5BrSO4��������������һ�ֻ�ѧʽΪ[Co(NH3)5Br]SO4��������Һ�м�BaCl2��Һʱ��������____________������һ����������Һ�м���BaCl2��Һʱ������������������AgNO3��Һʱ����������ɫ��������ڶ��������Ļ�ѧʽΪ _______________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ�����ȷ����( )
ͼ 1 ͼ 2
ͼ 2  ͼ 3
ͼ 3  ͼ 4
ͼ 4
A.��ͼ1��֪��Ӧ�ڵĵ�I���ȵ�������Ӧ���ʿ�
B.��ͼ2Ϊ1 mL pH��2ijһԪ����Һ��ˮϡ��ʱpH����Һ������ı仯���ߣ���˵��������ǿ��
C.��ͼ3֪��Ӧ3A(g)��2B(g) 2C(g) �� ��H>0����a��1.5
D.��ͼ4��ʾ��������0.1000mo1/L NaOH��Һ�ζ�25.00mL CH3COOH��Һ�ĵζ����ߣ���c(CH3COOH)=0.1000mo1/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ָ߷��ӻ����������Ŀǰ�г������е�ǽ��Ϳ��֮һ����ϳ�·�����£���Ӧ����һ�������½��У���

�ش��������⣺
��1��������I�����������ŵ�������_____________����CH2=CH2���ɻ������ķ�Ӧ������__________��
��2���ֱ�д���ϳ���·�ӻ�����ӻ�����������Ļ�ѧ����ʽ_______________________________��_______________________________��
��3�����������һ�������¿����ɻ�״������C3H4O2����д���û�����Ľṹ��ʽ_______________��
��4�����й��ڻ�������͢���˵���У���ȷ����_____________��
A�����������Է���������Ӧ
B�������������NaOH��Һ��Ӧ
C����������������������ӳɷ�Ӧ
D�������������������Ʒ�Ӧ��������
E����������͢�������ʹ������Ȼ�̼��Һ��ɫ
��5���뻯����V������ͬ�����ŵ�V��ͬ���칹����_________�֣�������������V�������Ҳ����������칹����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ�ũҵ�����о��й㷺��Ӧ�á������ʲ��ȶ��������ֽ������������н�ǿ�Ļ�ԭ�ԡ�
��.ijѧϰС����������װ����̽��FeSO4���ȷֽ�IJ��
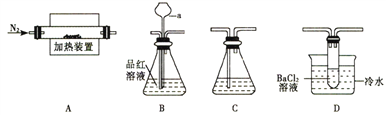
(1)����ͬѧ���á�A��B��C����װ������֤�����к���SO2���塣
�����Ӻ�װ�ú������IJ�����____________________��
������a��������_______________����������____________________��
(2)����ͬѧ�������ϵã����������ֽ����������г�SO2���SO3��SO3���۵�Ϊ16.8�棬�е���46.8�棬����ˮ�ų�������Ȼ�����γ�������Ϊ������ˡ�A��D��C����װ����֤�����к���SO3��
��װ��D�е�������_________________��BaCl2��Һ������Ba(NO3)2��Һ�����ԭ����______________________��
��װ��A�й����Ϊ������ɫ���������ͬѧ��ʵ�飬д�����������ֽ�Ļ�ѧ����ʽ______________________��
��ȡ����������Ʒ18.20g�����ȷֽ�������ʱ��ù�������Ϊ11.00g(�������ʲ���Ӧ)��������������Ʒ�Ĵ���Ϊ__________%(����С�������λ����ͬ)����Ʒ����Ԫ�ص���������Ϊ_____________��
��.����������������ֽ�ɼ���ʳƷ���Ƿ���CN-���������£�

��֪����ɫȾ����³ʿ���ĺϳɷ������£�
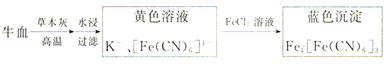
(3)����ֽ������֤��ʳƷ�к���CN-��������³ʿ���ĺϳ�ԭ��������ͼ��ʱ��ֽ������ԭ��______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������![]() �ֳƱ��շۣ���ӡˢ��ҵ����Ҫ�Ļ�ԭ����ij����С���������ʵ�顣
�ֳƱ��շۣ���ӡˢ��ҵ����Ҫ�Ļ�ԭ����ij����С���������ʵ�顣
��.���IJ���
i.������������![]() ��һ�ְ�ɫ��ĩ��������ˮ���������Ҵ���
��һ�ְ�ɫ��ĩ��������ˮ���������Ҵ���
ii.![]()
iii.![]()
II.�Ʊ�����
![]() ��ʱ�������ƺʹ�������Ҵ�ˮ��Һ�У�ͨ��
��ʱ�������ƺʹ�������Ҵ�ˮ��Һ�У�ͨ��![]() ���з�Ӧ������䷴Ӧ����ʽ��_____
���з�Ӧ������䷴Ӧ����ʽ��_____![]() ______
______ ![]() ______ = ______
______ = ______ ![]() ______
______ ![]() ____����ȴ��40����45�������ˣ��� ______ ϴ�ӣ������Ƶ�
____����ȴ��40����45�������ˣ��� ______ ϴ�ӣ������Ƶ�![]() ��
��
III.![]() ������
������
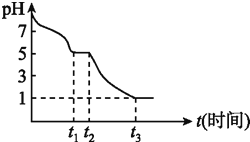
��1��![]() ��Һ�ڿ������ױ�����������С��ⶨ
��Һ�ڿ������ױ�����������С��ⶨ![]()
![]()
![]() ��Һ�ڿ�����pH�仯��ͼ��
��Һ�ڿ�����pH�仯��ͼ��![]() ����Ҫ����
����Ҫ����![]() ������pH�仯ͼ��
������pH�仯ͼ��![]() �ĵ���ƽ�� ______ ˮ��ƽ��
�ĵ���ƽ�� ______ ˮ��ƽ��![]() ����
����![]() ������
������![]() ��
��![]() ������С���Ʋ�
������С���Ʋ�![]() ��Һ�ڿ������ױ�������
��Һ�ڿ������ױ�������![]() �������ӷ�Ӧ����ʽΪ ______
�������ӷ�Ӧ����ʽΪ ______ ![]() ʱ��Һ����Ҫ�����ӷ����� ______ ��
ʱ��Һ����Ҫ�����ӷ����� ______ ��
��2��������������![]() ������ȫ�ֽ�õ��������
������ȫ�ֽ�õ��������![]() ��
��![]() ������Ϊ ______
������Ϊ ______ ![]() �ѧʽ
�ѧʽ![]() �������ʵ����֤������
�������ʵ����֤������![]() ���ڣ�����±������ݣ�
���ڣ�����±������ݣ�![]() ��ѡ����Լ���ϡ���ᡢϡ���ᡢ
��ѡ����Լ���ϡ���ᡢϡ���ᡢ![]() ��Һ��
��Һ��![]() ��Һ
��Һ![]()
ʵ�鲽�� | Ԥ�ڵ�ʵ������ͽ��� |
________ | ________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�塢����Ԫ�ؼ��仯����������������ͻ���������Ӧ�ù㷺��
��1�������й��������ʵݱ�������У���ȷ����________________������ţ���
A�����ԣ�HNO3>H2CO3>H2SiO3 B���ȶ��ԣ�NH3>AsH3>PH3
C���ȶ��ԣ�N2<P4�����ף� D�������£�ͬŨ����Һ��pH��Na3PO4<Na3AsO4
��2����֪��
(a)CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H1=��890.3 kJ��mol1
(b)2H2(g)+O2(g)=2H2O(l) ��H2=��571.6 kJ��mol1
(c)C(s)+O2(g)=CO2(g) ��H3=��393.5 kJ��mol1
��C(s)+2H2(g)=CH4(g) ��H=___________kJ��mol1��
��CH4�Ʊ��ϳ�����ԭ����CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)��
2CO(g)+2H2(g)��
A. �����������ܱ�ʾ�÷�Ӧ�ں��º��������´ﵽƽ��״̬����____��
a. ��������ѹǿ���ٷ����仯
b. ���������ܶȲ��ٷ����仯
c. ��Ӧ������CO2��CO�����ʵ����ı�ֵ���ٷ����仯
d. ��������ƽ����Է����������ٷ����仯
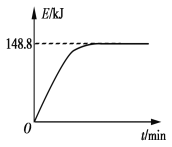
B. ��1 g CH4(g)��ȫ��Ӧ��������Ϊ15.5 kJ���ں����ܱ������г���1 mol CH4��1 mol CO2��һ�������·�Ӧ����ϵ������������ʱ��仯��ͼ��ʾ���ڸ������£���������ת���ʣ�����Ϊ____________��
��3�����ܱ������з�����Ӧ��2NO(g)+H2(g)= N2(g)+2H2O(g)���䷴Ӧ������Ũ�ȹ�ϵʽΪv=kcm(NO)��cn(H2)��kΪ������ֻ���¶��йأ�m��nΪ��Ӧ������ȡ������������ij�¶��²���й����������ʾ��
���� | c(NO)/(mol��L1) | c(H2)/(mol��L1) | v/(mol��L1��min1) |
�� | 0.10 | 0.10 | 0.414 |
�� | 0.20 | 0.20 | 3.312 |
�� | 0.10 | 0.20 | 0.828 |
�ܷ�Ӧ���������У���i����2NO+H2=N2+H2O2(����)����ii����H2O2+H2![]() 2H2O���ܿ죩���������¶��£���c(NO)=c(H2)=0.50 mol��L1ʱv=_________mol��L1��min1��
2H2O���ܿ죩���������¶��£���c(NO)=c(H2)=0.50 mol��L1ʱv=_________mol��L1��min1��
��4����2 L�����ܱ������г���3 mol NO(g)��3 mol CO(g)��������Ӧ��2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)����һ���¶��´ﵽƽ�⣬���ƽ����ϵ��c(N2)=0.5 mol��L1�����������ƽ�ⳣ��KֵΪ_______����Ӧǰ������������ѹǿ֮��Ϊ_________________________��
N2(g)+2CO2(g)����һ���¶��´ﵽƽ�⣬���ƽ����ϵ��c(N2)=0.5 mol��L1�����������ƽ�ⳣ��KֵΪ_______����Ӧǰ������������ѹǿ֮��Ϊ_________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com