
����Ŀ��һ�ָ߷��ӻ����������Ŀǰ�г������е�ǽ��Ϳ��֮һ����ϳ�·�����£���Ӧ����һ�������½��У���

�ش��������⣺
��1��������I�����������ŵ�������_____________����CH2=CH2���ɻ������ķ�Ӧ������__________��
��2���ֱ�д���ϳ���·�ӻ�����ӻ�����������Ļ�ѧ����ʽ_______________________________��_______________________________��
��3�����������һ�������¿����ɻ�״������C3H4O2����д���û�����Ľṹ��ʽ_______________��
��4�����й��ڻ�������͢���˵���У���ȷ����_____________��
A�����������Է���������Ӧ
B�������������NaOH��Һ��Ӧ
C����������������������ӳɷ�Ӧ
D�������������������Ʒ�Ӧ��������
E����������͢�������ʹ������Ȼ�̼��Һ��ɫ
��5���뻯����V������ͬ�����ŵ�V��ͬ���칹����_________�֣�������������V�������Ҳ����������칹����
���𰸡��ǻ�����ԭ�� �ӳɷ�Ӧ CH2(OH)CH2Cl + HCN ![]() CH2(OH)CH2CN + HCl CH2=CH-COOH + CH3OH
CH2(OH)CH2CN + HCl CH2=CH-COOH + CH3OH ![]() CH2=CH-COOCH3+H2O
CH2=CH-COOCH3+H2O ![]() ACDE 4
ACDE 4
��������
�������̿�֪����ϩ������ᷢ���ӳɷ�Ӧ������CH2Cl-CH2OH������HCN��Ӧ����NC-CH2-CH2OH��������CH2��OH��-CH2-COOH���ٷ�����ȥ��Ӧ����CH2=CH-COOH����״�����������Ӧ����CH2=CH-COOCH3��������Ӿ۷�Ӧ����![]() ��
��
��1��������IΪCH2Cl-CH2OH�����������ŵ�����Ϊ�ǻ�����ԭ�ӣ���ӦI����ϩ�е�˫����Ϊ��������Ӧ����Ϊ�ӳɷ�Ӧ��
��2��CH2Cl-CH2OH��HCN����ȡ����Ӧ����NC-CH2-CH2OH��HCl������ʽΪCH2(OH)CH2Cl + HCN ![]() CH2(OH)CH2CN + HCl��CH2=CH-COOH��״�����������Ӧ����CH2=CH-COOCH3��ˮ������ʽΪCH2=CH-COOH + CH3OH
CH2(OH)CH2CN + HCl��CH2=CH-COOH��״�����������Ӧ����CH2=CH-COOCH3��ˮ������ʽΪCH2=CH-COOH + CH3OH ![]() CH2=CH-COOCH3+H2O��
CH2=CH-COOCH3+H2O��
��3����������ΪCH2��OH��-CH2-COOH��һ����������������������Ӧ���ɻ�״������ṹ��ʽΪ![]() ��
��
��4����������ΪCH2��OH��-CH2-COOH�����еĹ�����Ϊ�ǻ����Ȼ�������Na�������ᷢ����Ӧ������NaOH��Ӧ���ɷ���������Ӧ����ʹ���Ը��������Һ��ɫ����ΪCH2=CH-COOH������̼̼˫�����Ȼ����ɷ����Ӿ۷�Ӧ���ӳɷ�Ӧ��������Ӧ�����봼����������Ӧ����NaOH�����кͷ�Ӧ����Na��Ӧ������������ΪCH2=CH-COOCH3���ɷ����Ӿ۷�Ӧ���ӳɷ�Ӧ��������Ӧ����������ˮ�ⷴӦ�����ΪACDE��
��5��������VΪCH2=CH-COOCH3������̼̼˫����������ͬ���칹��ΪCH3COOCH=CH2��HCOOCH=CHCH3��HCOOC��CH3��=CH2��HCOO CH2CH=CH2���ϼ�4�֡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ��CO2�ı�����Һ�����д�������ƽ�⣺
H2CO3![]() H����HCO3�������� HCO3��
H����HCO3�������� HCO3��![]() H����CO32��������
H����CO32��������
����ˮ�����Թ��зֱ��������ʵ�飬��Ӧ�������۴������
A.���ȡ�ƽ�����������ܶ������ƶ�
B.�������ʯ��ˮ��ƽ���������������ƶ�
C.����CaCO3����Һ��CaCO3���ܽ�ƽ�����������ƶ�
D.ͨ�����CO2��μ���ˮ����ҺpH����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ���Ȼ�ѧ����ʽ��
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)��H1
2 H2(g)+ O2(g)= 2H2O(g)��H2
C(s)+ O2(g)=CO2(g)��H3
��Ӧ4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)����HΪ
A. 12��H3+5��H2-2��H1 B. 2��H1-5��H2-12��H3
C. 12��H3-5��H2-2��H1 D. ��H1-5��H2-12��H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��pH��1����������ҺA��B��1 mL���ֱ��ˮϡ�͵�1000mL����pH����Һ���V�Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����

A.��������Һ�����ʵ���Ũ��һ�����B.ϡ�ͺ�A����Һ�����Ա�B����Һ��
C.��a��4����A��ǿ�ᣬB������D.��1��a��4����A��B��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ����Ǻϳ������ȣ�SO2Cl2���ij��÷�����ʵ���Һϳ������ȣ�SO2Cl2���ķ�Ӧ��ʵ��װ�����£�
SO2(g)��Cl2(g) ![]() SO2Cl2(l) ��H��- 92.7 kJ/mol
SO2Cl2(l) ��H��- 92.7 kJ/mol

�й���Ϣ���£�������ͨ��������Ϊ��ɫҺ�壬�۵�Ϊ��54.1 �棬�е�Ϊ69.1 �棬�ܶ�Ϊ1.67g /cm3���ڳ�ʪ����������������100�����Ͽ�ʼ�ֽ⣬���ɶ�����������������ڷ���Ҳ�ᷢ���ֽ⡣�ش��������⣺
��1��װ�ü�������A������Ϊ___________�����л���̿��������________��B������Ϊ_________��
��2��װ�ö��з�����Ӧ�����ӷ���ʽΪ__________________________��
��3��װ�ñ��е��Լ�Ϊ____________________����ȱ��װ���ң������Ͷ���������ܷ�����Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
��4��Ϊ��߱�ʵ���������ȵIJ��ʣ���ʵ���������Ҫע���������_______������ţ���
����ͨ����ˮ����ͨ�� �ڿ����������ʣ��������˿�
����������ƿ���̣����ʵ����� �ܼ���������ƿ
��5����ʵ����ͨ��SO2�����Ϊ11.2 L��������ɱ�״������Cl2���㣬ʵ�������ռ���������27.0 mL���������ȵIJ���Ϊ_________________���������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ͼ1��a��b�ֱ�Ϊ�����������NaOH��Һ���ε�pH�仯���ߣ�ͼ2Ϊ������CaSO4��ˮ�еij����ܽ�ƽ������[Ksp(CaSO4)=9��10-6]���������������ȷ����
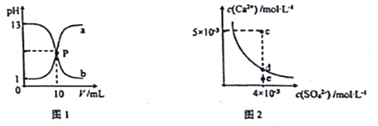
A. ͼ1��P����Һ��c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. ��ͼ1��֪�����NaOH��Һ��Ũ�Ⱦ�Ϊ1mol��L-1
C. ͼ2��c���г������ɣ���ƽ�����Һ��c(SO42-)=3��10-3 mol��L-1
D. ��ͨ��������ͼ 2��e�����Һ�䵽d��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuCl����ʰ�ɫ���۵�Ϊ430�����е�Ϊ1490��������ֽ⣬¶���ڳ�ʪ�������ױ�������������ˮ��ϡ���ᡢ�Ҵ���������Ũ��������H3CuCl4����Ӧ�Ļ�ѧ����ʽΪCuCl��s��+3HCl��aq��H3CuCl4��aq����
��1��ʵ��������ͼ1��ʾװ����ȡCuCl����Ӧԭ��Ϊ��
2Cu2++SO2+8Cl��+2H2O�T2CuCl43��+SO![]() +4H+
+4H+
CuCl43����aq��CuCl��s��+3Cl����aq��
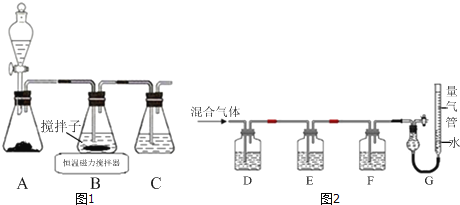
��װ��C��������_____��
��װ��B�з�Ӧ������ȡ������������ͼ��ʾ�������õ�CuCl���壮
�����![]()
![]()
![]()
![]()
![]() CuCl����
CuCl����
����������ҪĿ����_____
�����������ѡ�õ��Լ���_____��
��ʵ���ұ�������CuCl����ķ�����_____��
�����ᴿij����ͭ�۵�CuCl���壬�����ʵ�鷽����_____��
��2��ijͬѧ������ͼ2��ʾװ�ã��ⶨ��¯ú����CO��CO2��N2��O2�İٷ���ɣ�
��֪��
i��CuCl��������Һ������CO�γ�Cu��CO��ClH2O��
ii�����շۣ�Na2S2O4����KOH�Ļ����Һ������������
��D��Fϴ��ƿ����ʢ�ŵ��Լ��ֱ���_____��_____��
��д�����շۺ�KOH�Ļ����Һ����O2�����ӷ���ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ƿ�м������ʻ����ʼ��������ӳ��ʻ���������
��1������һ����ɫ���ʻ�Ӫ��Һ������������ơ�̼��ء�����ء��Ȼ����е�һ�ֻ���������ɣ�Ϊ̽����ɷ֣�ijͬѧ��Ʋ����������ͼ��ʾ��ʵ�顣
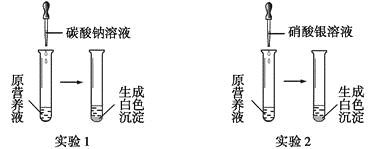
��������ʵ�飬������ա�
����ʵ��1��ȷ��ԭӪ��Һ��һ��û�е�������__________(�ѧʽ)��д�����ɰ�ɫ���������ӷ���ʽ��________________________��
�������ԭӪ��Һ��K+��Cl-����Ŀ֮��Ϊ2��1����ԭӪ��Һ����____���������Ƴɵġ�
��ijͬѧ���Ȼ��ơ�����ء��Ȼ�����ɵ�Ӫ��Һ��K+��Cl-��NO3-����Ŀ֮��Ϊ2��5��1������������غ��Ȼ��Ƶ����ʵ���֮����__________��
��2���±���500mLij���ʻ����ʼ����к��еijɷ֣��Ķ���ش��������⡣
�ɷ� | ������g�� | Ħ��������g ��mol-1�� |
���� | 68.4 | 342 |
����� | 0.50 | 174 |
��˾ƥ�� | 0.35 | 180 |
������� | 0.50 | 158 |
������ | 0.04 | 170 |
�����ʻ����ʼ��������ǵ����ʵ���Ũ��Ϊ___________________��
�����Ƹ�500mL ���ʻ����ʼ�������IJ������������ձ�������������Ͳ���________��
������Һ���ƹ����У����в�����ʹ���ƽ��ƫС����___________��
A������ʱ��������ƿ�̶���
B������ƿ��ʹ��ǰδ�����������������ˮ
C����Һʱ��Һ�岻С�Ĵ��������
D������ҡ�Ⱥ���Һ���������ƿ�Ŀ̶��ߣ���δ���κδ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10 L�����ܱ������г���X(g)��Y(g)��������ӦX(g)��Y(g) ![]() M(g)��N(g)������ʵ���������±���
M(g)��N(g)������ʵ���������±���
ʵ�� ��� | �¶�/�� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(X) | n(Y) | n(M) | |||
�� | 700 | 0.40 | 0.10 | 0.090 | |
�� | 800 | 0.10 | 0.40 | 0.080 | |
�� | 800 | 0.20 | 0.30 | a | |
�� | 900 | 0.10 | 0.15 | b | |
����˵����ȷ����(����)
A. ʵ�����У���5 minʱ���n(M)��0.050 mol����0��5 minʱ���ڣ���N��ʾ��ƽ����Ӧ����v(N)��1.0��10��2 mol��L��1��min��1
B. ʵ�����У��÷�Ӧ��ƽ�ⳣ��K��2.0
C. ʵ�����У��ﵽƽ��ʱ��X��ת����Ϊ60%
D. ʵ�����У��ﵽƽ��ʱ��b>0.060
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com