
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。
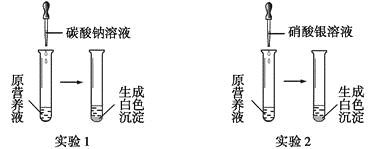
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是__________(填化学式),写出生成白色沉淀的离子方程式是________________________。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由____种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,则所用硝酸钾和氯化钙的物质的量之比是__________。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 68.4 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有________。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
【答案】碳酸钾 Ca2++CO32-=CaCO3↓ 3 1:2 0.4 molL-1 500mL容量瓶、胶头滴管 AC
【解析】
(1)①能和碳酸钠反应生成白色沉淀的是硝酸钙,所以一定有硝酸钙,而碳酸钾和硝酸钙能发生反应,所以没有碳酸钾。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液中一定含有硝酸钾、氯化钾。
③根据原子守恒计算硝酸钾和氯化钙的物质的量之比。
(2)①根据蔗糖的质量计算蔗糖的物质的量,然后用体积计算蔗糖的物质的量浓度。
②根据配制一定物质的量浓度的溶液确定需要的玻璃仪器。
③根据![]() 讨论误差。
讨论误差。
(1)①向营养液中加入碳酸钠溶液产生白色沉淀,说明营养液中含有硝酸钙,不能含有碳酸钾。它们会发生离子反应。生成白色沉淀的离子方程式是Ca2++CO32-=CaCO3↓。②由于原营养液中K+、Cl-的数目之比为2∶1,不含碳酸钾,KCl中二者的比是1:1,原物质含有钾不含氯的物质只可能是硝酸钾。故原营养液是由有硝酸钙、硝酸钾、氯化钾三种物质配制而成。③由氯化钙、硝酸钾、氯化钾配成的营养液中,K+、Cl-、NO3-的数目之比为2∶5∶1,假设n(NO3-)=1mol,则n(KNO3)=1 mol,n(KCl)=1mol,n(CaCl2)=2mol。所以n(KNO3): n(CaCl2)=1:2。
(2)①c(蔗糖)=![]()
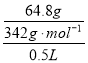 =0.4 molL-1。准确配制500mL一定浓度的溶液需500mL的容量瓶及胶头滴管。③在溶液配制过程中A.定容时仰视容量瓶刻度线,加水过多,浓度偏低,正确。B.容量瓶在使用前未干燥,里面有少量蒸馏水,后来加入的水就少些,但最终量没变,所以浓度没变化。错误。C.在移液时,液体不小心从外壁流出,会导致溶质减少。浓度偏低。正确。D.溶液的特性是均一性、稳定性。若定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理。不会产生任何影响。错误。故导致浓度偏小的是AC。
=0.4 molL-1。准确配制500mL一定浓度的溶液需500mL的容量瓶及胶头滴管。③在溶液配制过程中A.定容时仰视容量瓶刻度线,加水过多,浓度偏低,正确。B.容量瓶在使用前未干燥,里面有少量蒸馏水,后来加入的水就少些,但最终量没变,所以浓度没变化。错误。C.在移液时,液体不小心从外壁流出,会导致溶质减少。浓度偏低。正确。D.溶液的特性是均一性、稳定性。若定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理。不会产生任何影响。错误。故导致浓度偏小的是AC。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料。以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,主要反应为![]()
![]()
![]()
已知相关燃烧热数据:
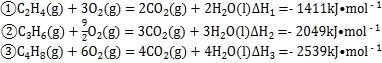
下列说法不正确的是 ( )
A. 消耗等物质的量的原料,反应③的放热最显著
B. 放出相等的热量,反应①产生的![]() 最少
最少
C. “烯烃歧化“反应中消耗![]() ,放热
,放热![]()
D. “烯烃歧化”反应中断键吸收的能量比成键放出的能量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):

回答下列问题:
(1)化合物I中所含官能团的名称是_____________,由CH2=CH2生成化合物Ⅰ的反应类型是__________。
(2)分别写出合成线路从化合物Ⅰ到Ⅱ、从化合物Ⅳ到Ⅴ的化学方程式_______________________________、_______________________________。
(3)化合物Ⅲ在一定条件下可生成环状化合物C3H4O2,请写出该化合物的结构简式_______________。
(4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是_____________。
A.化合物Ⅲ可以发生氧化反应
B.化合物Ⅲ不可以与NaOH溶液反应
C.化合物Ⅳ能与氢气发生加成反应
D.化合物Ⅲ、Ⅳ均可与金属钠反应生成氢气
E.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色
(5)与化合物V具有相同官能团的V的同分异构体有_________种(不包括化合物V本身,且不考虑立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠![]() 又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验。
Ⅰ.查阅材料
i.连二亚硫酸钠![]() 是一种白色粉末,易溶于水,难溶于乙醇。
是一种白色粉末,易溶于水,难溶于乙醇。
ii.![]()
iii.![]()
II.制备方法
![]() ℃时将甲酸钠和纯碱加入乙醇水溶液中,通入
℃时将甲酸钠和纯碱加入乙醇水溶液中,通入![]() 进行反应,完成其反应方程式:_____
进行反应,完成其反应方程式:_____![]() ______
______ ![]() ______ = ______
______ = ______ ![]() ______
______ ![]() ____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得
____,冷却至40℃~45℃,过滤,用 ______ 洗涤,干燥制得![]() ;
;
III.![]() 的性质
的性质
(1)![]() 溶液在空气中易被氧化,课题小组测定
溶液在空气中易被氧化,课题小组测定![]()
![]()
![]() 溶液在空气中pH变化如图:
溶液在空气中pH变化如图:![]() 段主要生成
段主要生成![]() ,根据pH变化图,
,根据pH变化图,![]() 的电离平衡 ______ 水解平衡
的电离平衡 ______ 水解平衡![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,课题小组推测
,课题小组推测![]() 溶液在空气中易被氧化,
溶液在空气中易被氧化,![]() 发生离子反应方程式为 ______
发生离子反应方程式为 ______ ![]() 时溶液中主要阴离子符号是 ______ 。
时溶液中主要阴离子符号是 ______ 。
(2)隔绝空气加热![]() 固体完全分解得到固体产物
固体完全分解得到固体产物![]() 、
、![]() 和气体为 ______
和气体为 ______ ![]() 填化学式
填化学式![]() 请你设计实验验证产物有
请你设计实验验证产物有![]() 存在,完成下表中内容.
存在,完成下表中内容.![]() 供选择的试剂:稀盐酸、稀硝酸、
供选择的试剂:稀盐酸、稀硝酸、![]() 溶液、
溶液、![]() 溶液
溶液![]()
实验步骤 | 预期的实验现象和结论 |
________ | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()
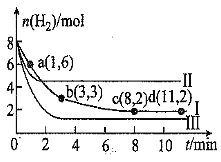
A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料。
(1)标准状况下,22.4L Cl2的物质的量为________mol。
(2)实验室制取Cl2的化学方程式为 ________________________。
(3)收集Cl2应使用 _________ 法,要得到干燥的Cl2可选用 _______ 做干燥剂。
(4)写出实验室制取漂白液的反应的离子方程式 ______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各种微粒浓度大小关系或结论正确的是( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: ![]()
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(H+)=2c(OH-)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是( )

A.盐酸的浓度越大,腐蚀速率越快
B.碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
C.钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
D.对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com