
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()
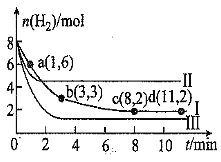
A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
【答案】C
【解析】
A.![]() 内,
内, ![]() (H2)=
(H2)=  0.375 mol/(L·min),
0.375 mol/(L·min),![]() (CO2)=
(CO2)=![]()
![]() (H2)=0.125 mol/(L·min),A错误;
(H2)=0.125 mol/(L·min),A错误;
B.向容积为2L的恒容密闭容器中充入![]() 和
和![]() ,达到平衡状态时,氢气的物质的量为2mol,根据方程式
,达到平衡状态时,氢气的物质的量为2mol,根据方程式![]()
![]()
![]() 可知,消耗氢气6mol、消耗二氧化碳2mol,生成甲醇2mol、生成水蒸气2mol,所以平衡时氢气的体积分数为
可知,消耗氢气6mol、消耗二氧化碳2mol,生成甲醇2mol、生成水蒸气2mol,所以平衡时氢气的体积分数为![]() ,保持温度不变,若起始时充入
,保持温度不变,若起始时充入![]() 和
和![]() ,相当于减小压强,平衡逆向移动,则平衡时氢气的体积分数大于
,相当于减小压强,平衡逆向移动,则平衡时氢气的体积分数大于![]() ,B错误;
,B错误;
C.根据B选项,平衡时,![]() ,
,![]() ,
,![]() ,
,![]() ,平衡常数
,平衡常数![]() ,保持温度不变,若起始时向上述容器中充入
,保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,容器体积为2L,
,容器体积为2L,![]() ,反应正向进行,C正确;
,反应正向进行,C正确;
D.升高温度,平衡逆向移动,平衡时氢气的物质的量增大,Ⅱ可能是升高温度;恒容充入氦气,反应物的浓度不变,平衡不移动,D错误。
故选C。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是③O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )

A.反应O3+O===2O2的ΔH=E1-E3B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应D.ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
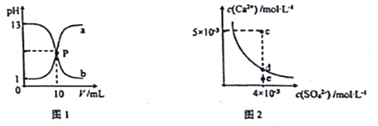
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
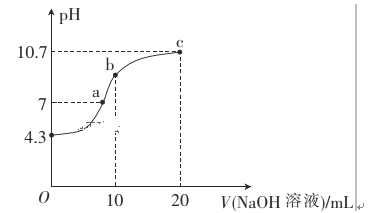
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____ c(N2O22-)(填“>”、“<”或“=”,下同)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中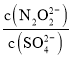 =__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。
(1)现有一种无色的鲜花营养液,可能由硝酸钙、碳酸钾、硝酸钾、氯化钾中的一种或几种物质组成,为探究其成分,某同学设计并完成了如下图所示的实验。
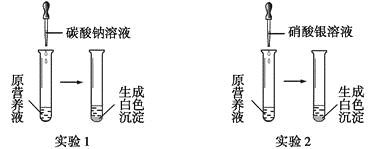
根据以上实验,请你填空。
①由实验1可确定原营养液中一定没有的物质是__________(填化学式),写出生成白色沉淀的离子方程式是________________________。
②若测得原营养液中K+、Cl-的数目之比为2∶1,则原营养液是由____种溶质配制成的。
③某同学用氯化钙、硝酸钾、氯化钾配成的营养液中K+、Cl-、NO3-的数目之比为2∶5∶1,则所用硝酸钾和氯化钙的物质的量之比是__________。
(2)下表是500mL某“鲜花保鲜剂”中含有的成分,阅读后回答下列问题。
成分 | 质量(g) | 摩尔质量(g ·mol-1) |
蔗糖 | 68.4 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
①“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
②配制该500mL “鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有________。
③在溶液配制过程中,下列操作能使配制结果偏小的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.移液时,液体不小心从外壁流出
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
苯 | 78 | 78 | 0.88 |
氯苯 | 112.5 | 132.2 | 1.1 |
邻二氯苯 | 147 | 180.4 | 1.3 |
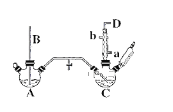
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式。_______________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______________,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2 mol A和1 mo B,发生反应:2A(g)+B(g)![]() 2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
2D(g) △H=Q kJ/mol,相关条件和数据见下表:下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
A.Q<0,K3>K2>K1
B.实验I和Ⅱ探究的是催化剂对于化学反应的影响
C.实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡向正向移动
D.A的转化率:Ⅲ![]() Ⅱ
Ⅱ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀法除去。已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-:Cr3++3OH ![]() Cr(OH)3
Cr(OH)3 ![]() CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=__________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为____________。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定终点的现象是__________________。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)Na2Cr2O7的含量也可以用一定难度的NaNO2溶液进行滴定。已知常温下HNO2的电离常数Ka=7.1×10-4 ,NH3·H2O的电离常数Kb=1.7×10-5 。0.1 mol·L-1 NH4NO2溶液中各离子浓度由大到小的顺序是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图能量关系示意图,下列说法正确的是
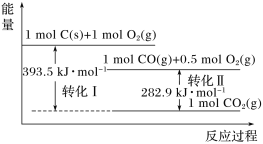
A. 1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g)= 2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com