
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
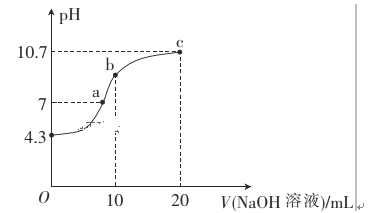
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____ c(N2O22-)(填“>”、“<”或“=”,下同)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中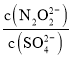 =__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
【答案】H2N2O2 HN2O2—+H+ (HN2O2— N2O22— +H+) > > 3.0×10—4.
【解析】
(1)①根据图象可知,0.01mol/L的H2N2O2溶液pH=4.3,说明H2N2O2为二元弱酸,分步电离,且以第一部电离为主;
②b点时溶液的溶质为NaHN2O2,溶液呈碱性,那么HN2O2-的水解程度大于电离程度;
③a点时溶液的pH=7,溶液呈中性,c(H+)=c(OH-),根据电荷守恒进行判断;
(2)根据Ksp(Ag2N2O2)=c2(Ag+)c(N2O22-),Ksp(Ag2SO4)= c2(Ag+)c(SO42-),分别计算出c(N2O22-)和c(SO42-),最后求比值。
(1)①根据图象可知,0.01mol/L的H2N2O2溶液pH=4.3,说明H2N2O2为二元弱酸,分步电离,且以第一部电离为主,因此电离方程式为:H2N2O2 HN2O2-+H+ (HN2O2- N2O22-+H+);
②b点时溶液的溶质为NaHN2O2,溶液呈碱性,那么HN2O2-的水解程度大于电离程度,因此c(H2N2O2) > c(N2O22-);
③a点时溶液的pH=7,溶液呈中性,c(H+)=c(OH-),根据电荷守恒有c(Na+)=c(HN2O2-)+2c(N2O22-),因此c(Na+)>c(HN2O2-)+c(N2O22-);
(2)根据Ksp(Ag2N2O2)=c2(Ag+)c(N2O22-)和 Ksp(Ag2SO4)= c2(Ag+)c(SO42-)可得c(N2O22-)=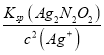 ,c(SO42-)=
,c(SO42-)=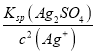 ,因此
,因此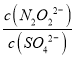 =
=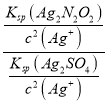 =
=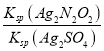 =
=![]() =3.0×10-4。
=3.0×10-4。


科目:高中化学 来源: 题型:
【题目】最近,著名记者柴静的雾霾调查纪录片![]() 穹顶之下
穹顶之下![]() ,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.
,在互联网上产生了爆炸性影响.煤燃烧的尾气是造成雾霾天气的原因之一,下列是一种变废为宝的处理方法.

(1)上述流程中循环使用的物质有 ______ ,吸收池Ⅰ吸收的气体有 ______ .
(2)向吸收池Ⅳ得到的![]() 溶液中滴加
溶液中滴加![]() 溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因: ______ .
(3)电解池Ⅴ制得![]() 的原理如图1所示.
的原理如图1所示.
写出电解总反应的离子方程式 ______ .

(4)![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() ,反应过程中的能量变化如图2,
,反应过程中的能量变化如图2,![]() ,
,![]() .
.
已知:①![]()
②![]()
请写出NO与CO反应生成无污染气体的热化学方程式: ______ .
(5)上述流程中每一步均恰好完全反应,若制得![]() 质量为xkg,电解池V制得
质量为xkg,电解池V制得![]() 的
的![]() 溶液
溶液![]() ,则氧化池Ⅵ中消耗的
,则氧化池Ⅵ中消耗的![]() 在标准状况下的体积为 ______
在标准状况下的体积为 ______ ![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() 的σ键和π键比例为4:1
的σ键和π键比例为4:1
B.某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C.Na、P、Cl的电负性依次增大
D.CH3CH(OH)COOH分子中有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨电极完成下列电解实验
实验一 | 实验二 | |
装置 |
|
|
现象 | a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 | 两个石墨电极附近有气泡产生;n处有气泡产生…… |
下列对实验现象的解释或推测不合理的是( )
A. a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑
C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素P的结构如图所示,其中R为烷烃基。下列关于维生素P的叙述正确的是
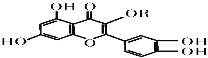
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为甲基,则该物质的分子式可以表示为C16H12O7
C.1 mol该化合物最多可消耗NaOH 为5mol
D.1 mol该化合物最多消耗溴水中的溴5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()
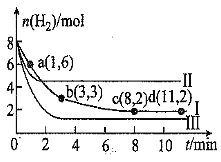
A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO3+NaNO2+H2O。将总体积共为40 mL的NO和O2两种气体分别同时通入同一足量的NaOH溶液中,完全反应后,溶液中只含有NaNO2和NaOH,剩余气体5 mL,则原混合气体中NO的体积为( )
A.20 mLB.25 mLC.12 mLD.33 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com