
【题目】下列说法不正确的是( )
A.![]() 的σ键和π键比例为4:1
的σ键和π键比例为4:1
B.某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C.Na、P、Cl的电负性依次增大
D.CH3CH(OH)COOH分子中有手性碳原子
【答案】A
【解析】
A. ![]() 的分子式为C4H8O4N2Cu,σ键和π键个数分别为18、2,其比例为9:1,符合题意,A正确;
的分子式为C4H8O4N2Cu,σ键和π键个数分别为18、2,其比例为9:1,符合题意,A正确;
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,根据数据可知,I2与I3差距较大,则其最外层有2个电子,当它与氯气反应时可能生成的阳离子是X2+,与题意不符,B错误;
C. Na、P、Cl为同一周期元素,原子序数依次增大,则电负性依次增大,与题意不符,C错误;
D. CH3CH(OH)COOH分子中CH的碳原子连接了4个不同原子团,为手性碳原子,与题意不符,D错误;
答案为A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硝基苯可在金属锡、盐酸作用下生成氯化苯铵盐(![]() )、氯化亚锡(SnCl2)和水。
)、氯化亚锡(SnCl2)和水。
(1)写出Sn2+的最外层电子排布式___________;Cl-中有_________个填充电子的能级。
(2)画出硝基的电子式____________,氯化亚锡分子的空间构型是________________;氯化苯胺盐(![]() )中N原子的杂化方式为_______________,该盐的水溶度较苯胺大的原因是____________________________________________________。
)中N原子的杂化方式为_______________,该盐的水溶度较苯胺大的原因是____________________________________________________。
(3)Sn的一种同素异形体——灰锡的晶体结构类似金刚石,立方晶胞结构如图所示,则锡的配位数是_______。

(4)假设锡原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,计算灰锡的空间利用率约为________________。(百分数表示,取两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是③O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )

A.反应O3+O===2O2的ΔH=E1-E3B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应D.ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:

(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是_______。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的是

A.两种酸溶液的物质的量浓度一定相等B.稀释后A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸D.若1<a<4,则A、B都是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.甲乙两池电极材料均为铁棒与铂棒,请回答下列问题:

(1)若电池中均为CuSO4溶液,则下列说法正确的是___________
A.一段时间后,甲乙两池中Pt棒上都有红色物质析出
B.甲池中Fe棒上发生氧化反应,乙池中Fe棒上发生还原反应
C.甲池中Cu2+向Fe棒移动,乙池中Cu2+向Pt棒移动
D.一段时间后,甲池中Fe棒质量减少,乙池中Fe棒质量增加
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式_____________________________________,乙池中Pt棒上的电极反应属于_______反应(填“氧化”或是“还原”)
②甲池中Pt棒上的电极反应式是_______________________________________
③室温下,若乙池转移0.02mol电子后停止实验,该池中溶液体积为2000mL,则溶液混合均匀后pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
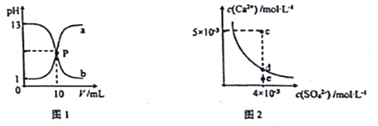
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
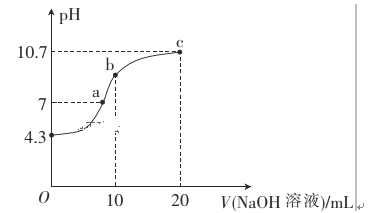
①写出H2N2O2在水溶液中的电离方程式:______________。
②b点时溶液中c(H2N2O2)_____ c(N2O22-)(填“>”、“<”或“=”,下同)。
③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中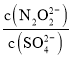 =__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀法除去。已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-:Cr3++3OH ![]() Cr(OH)3
Cr(OH)3 ![]() CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=__________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为____________。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定终点的现象是__________________。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)Na2Cr2O7的含量也可以用一定难度的NaNO2溶液进行滴定。已知常温下HNO2的电离常数Ka=7.1×10-4 ,NH3·H2O的电离常数Kb=1.7×10-5 。0.1 mol·L-1 NH4NO2溶液中各离子浓度由大到小的顺序是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com