
����Ŀ�����������ڽ����������������������Ȼ�����Σ�![]() �����Ȼ�������SnCl2����ˮ��
�����Ȼ�������SnCl2����ˮ��
��1��д��Sn2+�����������Ų�ʽ___________��Cl-����_________�������ӵ��ܼ���
��2�����������ĵ���ʽ____________���Ȼ��������ӵĿռ乹����________________���Ȼ������Σ�![]() ����Nԭ�ӵ��ӻ���ʽΪ_______________�����ε�ˮ�ܶȽϱ������ԭ����____________________________________________________��
����Nԭ�ӵ��ӻ���ʽΪ_______________�����ε�ˮ�ܶȽϱ������ԭ����____________________________________________________��
��3��Sn��һ��ͬ�������塪�������ľ���ṹ���ƽ��ʯ�����������ṹ��ͼ��ʾ����������λ����_______��

��4��������ԭ�ӣ���ͼ��A��B��ԭ�ӣ�����Խ��������У���������Ϊa����������Ŀռ�������ԼΪ________________�����ٷ�����ʾ��ȡ��λ��Ч���֣�
���𰸡� 5s2 5 ![]() V�� sp3 ���������ڼ����ܼ����ܽ�Ƚϴ��������ӿ����ܼ�ˮ�γɽ�ǿ��������ã�������������ˮ�ķ�֮�����ý�С 4 34%
V�� sp3 ���������ڼ����ܼ����ܽ�Ƚϴ��������ӿ����ܼ�ˮ�γɽ�ǿ��������ã�������������ˮ�ķ�֮�����ý�С 4 34%
����������1�����ĺ�������Ų�ʽΪ 1s2 2s2p6 3s23p63d10 4s24p64d10 5s25p2��ʧȥ5p2���Ӻ��γ�Sn2+����ʱ���������Ų�ʽΪ5s2��Cl-�ĵ����Ų�ʽΪ1s22s22p63s23p6������5�������ӵ��ܼ���
��2�� �����ṹΪ![]() �����������ʽΪ
�����������ʽΪ ![]() ��SnCl2 ����ԭ�Ӽ۲���Ӷ���Ϊ��4+2��/2=3�����ӶԹ���Ϊ�����Σ��ɼ����Ӷ���Ϊ2���µ��Ӷ���Ϊ1�����Է��ӹ���ΪV�͡�
��SnCl2 ����ԭ�Ӽ۲���Ӷ���Ϊ��4+2��/2=3�����ӶԹ���Ϊ�����Σ��ɼ����Ӷ���Ϊ2���µ��Ӷ���Ϊ1�����Է��ӹ���ΪV�͡�![]() ��Nԭ�ӵļ۲���Ӷ���Ϊ��5+4-1��/2=4�����Ե�ԭ�Ӳ�ȡsp3�ӻ���
��Nԭ�ӵļ۲���Ӷ���Ϊ��5+4-1��/2=4�����Ե�ԭ�Ӳ�ȡsp3�ӻ���![]() ���������ӹ��ɻ�������Խϴ�ˮΪ���Է��ӣ���
���������ӹ��ɻ�������Խϴ�ˮΪ���Է��ӣ���![]() ��ˮ�е��ܽ�Ƚϴ����������еĵ�ԭ����ˮ�е���ԭ�����γ������Ҳ��������ˮ�е��ܽ�Ƚϴ�����Ϊ�Ǽ��Է��ӣ���ˮ���Ӽ����������С�����ܽ�Ȳ���Ϊ�����������ڼ����ܼ����ܽ�Ƚϴ��������ӿ����ܼ�ˮ�γɽ�ǿ��������ã�������������ˮ�ķ�֮�����ý�С ��
��ˮ�е��ܽ�Ƚϴ����������еĵ�ԭ����ˮ�е���ԭ�����γ������Ҳ��������ˮ�е��ܽ�Ƚϴ�����Ϊ�Ǽ��Է��ӣ���ˮ���Ӽ����������С�����ܽ�Ȳ���Ϊ�����������ڼ����ܼ����ܽ�Ƚϴ��������ӿ����ܼ�ˮ�γɽ�ǿ��������ã�������������ˮ�ķ�֮�����ý�С ��
��3�������ľ���ṹ���ƽ��ʯ������Ϊ�����������ʯ�ͽṹ����λ����4.
��4������������Ŀռ�������Ϊ68%�����ľ���ʵ�ʺ�2��ԭ�ӣ����þ�����ʵ�ʺ�ԭ��8�����ֳ�8��������ÿ�������к�һ��ԭ�ӣ����Կռ�������Ϊ68%/2=34%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. 0.1 mol��L��1�Ĵ����ˮϡ�ͣ�c(CH3COOH)/c(CH3COO��)��С
B. ��ˮ�м������������������ƣ�c(H��)����Kw���
C. �����pH����ͬ�Ĵ����������ȫ�ܽ������þ��(����)������ʱ��
D. ������pH��11��NaOH��Һ��pH��3��CH3COOH��Һ�������ϣ���Һ�Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���K+��Na+��Fe3+��Fe2+��SO42-��CO32-��I-��Cl-�е�һ�ֻ���֣�������ͼ��ʾ��ʵ�飬����˵����ȷ���� ( )
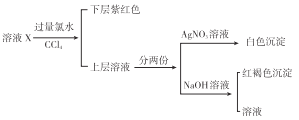
A. ��ҺX����Fe3+��SO42-
B. ��ҺX����Fe2+��I-������SO42-��Cl-
C. ��ҺX����I-��Cl-����CO32-
D. ��ҺX����I-��Fe2+��Fe3+����������������һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�����Һ�������գ����õ��Ĺ��������
A����ˮ���Ȼ��� B����������
C���������� D������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Һϳ����������IJ������£���Բ����ƿ�ڼ����Ҵ���Ũ��������ᣬƿ����ֱ��װͨ����ȴˮ�������ܣ�ʹ��Ӧ��������������ΪҺ��������ƿ�ڣ������Ȼ���һ��ʱ�������װ�ý������õ������Ҵ��������ˮ�����������ֲ�Ʒ��
��ش��������⣺
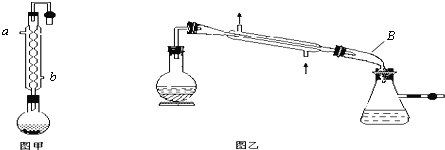
��1������ƿ�г��˼����Ҵ���Ũ����������⣬��Ӧ����__________��Ŀ����__________��
��2����Ӧ�м���������Ҵ���Ŀ����__________________________��
��3�����������ʵ�鲽���Ϊ��������ƿ���ȼ����Ҵ���Ũ���ᣬȻ��ͨ����Һ©���ߵ�
�������������������������������IJ��ʣ���ԭ����____________________��
��4���������ֲ�Ʒ����������������Ҵ��Ļ�������п�ͼ�Ƿ��������������ͼ��

���Լ�a�ǣ�____________�����뷽��I��____________�����뷽��II��____________��
�Լ�b��______________�����뷽��III��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�
A.�ڲ�����ˮ���¯������ҵ�����У�����Ҫ�õ�ʯ��ʯ
B.������Fe��Cl2��Ӧ����FeCl2
C.��ʯ������ʳƷ��������
D.̼������һ��ҽ��θ���кͼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������ҩ�Ϳ�ϵ�����Ӧ�ù㷺��(6�֣�ÿ��1��)

��
��1�����л���������˵������ȷ���� ��
A����FeCl3��Һ��������ɫ
B���ɷ���������Ӧ��������Ӧ
C�������巢��ȡ���ͼӳɷ�Ӧ
D��1 mol���������������2 mol NaOH��Ӧ
��2����Ӧ����һ����ϩ��ֱ���Ʊ������������·�����

���������ķ���ʽΪ ��1 mol������������ mol H2ǡ����ȫ��Ӧ���ɱ���������
��3�������������ɷ����廯�����������ֱ�ͨ����ȥ��Ӧ��ã���ֻ��������Na��Ӧ����H2�����Ľṹ��ʽΪ (д1��)�������������ķ�Ӧ����Ϊ ��
��4���ۺ���![]() �������Ʊ�Ϳ�ϣ��䵥��ṹ��ʽΪ________________��
�������Ʊ�Ϳ�ϣ��䵥��ṹ��ʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һ�ζ�����Ũ�ȵ�NaOH��Һ�����ü�����ָʾ�������ζ����յ�ʱ����Һ��ɫ�仯��(����)
A. �ɺ�ɫ���ɫ B. �ɻ�ɫ���ɫ C. �ɻ�ɫ���ɫ D. �ɳ�ɫ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ����

A. ��a�Թ����ȼ����Ҵ���Ȼ���ҡ���Թܱ���������Ũ���ᣬ�ټӱ�����
B. �ɽ�����̼������Һ��������������Һ
C. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���ԭ���Ƿ�ֹʵ������з�����������
D. ʵ��ʱ�����Թ�a��Ŀ���Ǽ�ʱ�����������������ӿ췴Ӧ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com