
����Ŀ����.��֪����![]()
��![]()
��![]()
�Ծݴ�д��һ����̼ȼ�յ��Ȼ�ѧ����ʽ___________________________��
��.�������ص缫���Ͼ�Ϊ�����벬������ش��������⣺

��1��������о�ΪCuSO4��Һ��������˵����ȷ����___________
A��һ��ʱ�����������Pt���϶��к�ɫ��������
B���׳���Fe���Ϸ���������Ӧ���ҳ���Fe���Ϸ�����ԭ��Ӧ
C���׳���Cu2+��Fe���ƶ����ҳ���Cu2+��Pt���ƶ�
D��һ��ʱ��׳���Fe���������٣��ҳ���Fe����������
��2���������о�Ϊ����NaCl��Һ��
��д���ҳ����ܷ�Ӧ�Ļ�ѧ����ʽ_____________________________________���ҳ���Pt���ϵĵ缫��Ӧ����_______��Ӧ������������ǡ���ԭ����
�ڼ׳���Pt���ϵĵ缫��Ӧʽ��_______________________________________
�������£����ҳ�ת��0.02mol���Ӻ�ֹͣʵ�飬�ó�����Һ���Ϊ2000mL������Һ��Ͼ��Ⱥ�pH=__________��
���𰸡�2CO(g)+O2(g)==2CO2(g) ��H = -566kJ��mol-1 BD 2NaCl+2H2O ![]() 2Na OH+H2��+Cl2�� ���� O2+2H2O+ 4e-4OH- 12
2Na OH+H2��+Cl2�� ���� O2+2H2O+ 4e-4OH- 12
��������
��.���ݸ�˹���ɼ���һ����̼ȼ�յķ�Ӧ�ȣ�д�����Ȼ�ѧ����ʽ��
��.��1���׳�Ϊԭ��أ��ҳ�Ϊ���أ�ԭ����л��ý���������������������Ӧ��Pt����������������ԭ��Ӧ�������������Ϸ���ʧ���ӵ�������Ӧ��
��2���ٸ��ݵ��صĹ���ԭ������д����Ȼ��Ƶ�ԭ������ʽ���ҳ�Ϊ���أ�Pt����������������ʧ���ӷ���������Ӧ��
���׳�Ϊԭ��أ�Pt���������������ϵõ��ӷ�����ԭ��Ӧ��
�۸���ת�Ƶ����غ�������ɵ��������Ƶ����ʵ������ٸ���ˮ�����ӻ�����������Һ��������Ũ�ȣ��Ӷ��ó���Һ��pH��
��. ���ݸ�˹���ɣ���![]() -��+�۵ã�2CO(g)+O2(g)==2CO2(g) ��H =��
-��+�۵ã�2CO(g)+O2(g)==2CO2(g) ��H =��![]() ��
��![]() 2-��
2-��![]() ��+
��+![]() = -566kJ��mol-1 ����һ����̼ȼ�յ��Ȼ�ѧ����ʽΪ2CO(g)+O2(g)==2CO2(g) ��H = -566kJ��mol-1 ��
= -566kJ��mol-1 ����һ����̼ȼ�յ��Ȼ�ѧ����ʽΪ2CO(g)+O2(g)==2CO2(g) ��H = -566kJ��mol-1 ��
��ˣ�������ȷ��Ϊ��2CO(g)+O2(g)==2CO2(g) ��H = -566kJ��mol-1 ��
��.��1��������о�ΪCuSO4��Һ��
A���׳���ԭ��أ��׳���Pt����������������ԭ��Ӧ��Cu2++2e-=Cu���к�ɫͭ�������ҳ��ǵ��أ��ҳ���Pt�����Դ����������������������������Ӧ��û�к�ɫͭ��������A����
B���׳���Fe��������������������Ӧ���ҳ���Fe���͵�Դ������������������������ԭ��Ӧ����B��ȷ��
C���׳���ԭ��أ�Cu2+��������Pt�����ƶ����ҳ��ǵ��أ�Cu2+��������Fe�����ƶ�����C����
D���׳���ԭ��أ��׳���Fe��������������������Ӧ��Fe-2e-=Fe2+��Fe���������٣��ҳ��ǵ��أ��ҳ���Fe�����Դ������������������������ԭ��ӦCu2++2e-=Cu��Fe���������ӣ���D��ȷ��
��ˣ�������ȷ��Ϊ��BD��
��2�������������ҺΪ�����Ȼ�����Һ�����ҳؾ����ö��Ե缫Ϊ��������Ȼ�����Һ������ʽΪ��2NaCl+2H2O ![]() 2Na OH+H2��+Cl2����Pt����������������Cl-ʧ���ӷ���������Ӧ��
2Na OH+H2��+Cl2����Pt����������������Cl-ʧ���ӷ���������Ӧ��
��ˣ�������ȷ��Ϊ��2NaCl+2H2O ![]() 2Na OH+H2��+Cl2�� ��������
2Na OH+H2��+Cl2�� ��������
�ڼ׳�Ϊԭ��أ�Pt����������������O2�õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪO2+2H2O+ 4e-4OH-��
��ˣ�������ȷ��Ϊ��O2+2H2O+ 4e-4OH-��
������Ȼ�����Һ�ķ���ʽΪ��2NaCl+2H2O ![]() 2Na OH+H2��+Cl2�����ҳ�ת��0.02mole-������0.02mol���������ƣ���������NaOH��Һ�����ʵ���Ũ��c=n/V=0.02mol/2L=0.01mol/L��c(H+)=10-14/0.01mol/L=10-12mol/L����pH=12��
2Na OH+H2��+Cl2�����ҳ�ת��0.02mole-������0.02mol���������ƣ���������NaOH��Һ�����ʵ���Ũ��c=n/V=0.02mol/2L=0.01mol/L��c(H+)=10-14/0.01mol/L=10-12mol/L����pH=12��
��ˣ�������ȷ��Ϊ��12��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ȼ�п���л��ϳ�����Ҫ��������ˮ�Ȼ�пΪ��ɫ��ĩ���׳��⣬�е�Ϊ732�档���������Ȼ�п����Zn(OH)Cl��Ӱ���Ч����ʵ������HC1���塰�û�����ˮ�������Ȼ�п���ϵķ����ᴿ�����Ȼ�п��
(1)ѡ����ͼ��ʾ��װ��(�����ظ�ѡ��)����ʵ�飬װ�ýӿ��������ӵĺ���˳��Ϊ��a��___________��
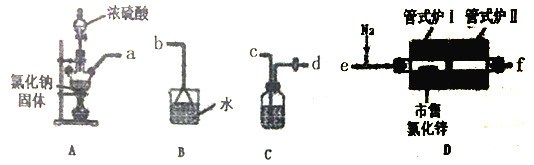
(2)װ��Aʢ�Ȼ��ƹ��������������___________��װ��C���Լ���___________��
(3)ʵ�鿪ʼʱ��ͨ��HC1��N2������ʽ¯I����������150�棬װ��D�з����Ļ�ѧ��Ӧ����ʽΪ___________����ʱͨ��N2��Ŀ����______________________��
(4)��Ӧһ��ʱ��ֹ�ʽ¯I�����¶�Ϊ350�棬��֤��ˮ��������______________________��(�����)����ڵ��������½��Ȼ�п�γ��������⣬������á�
(5)����ȡ100.00g�����Ȼ�п��Ʒ�����ᴿ���յõ��ߴ��Ȼ�п100.3g������Ʒ���Ȼ�п����Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī�缫����������ʣ������缫�϶��������������( )
A.����ʳ��ˮB.�Ȼ�ͭ��ҺC.����������D.�����Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪һ���¶��£�X��g��+2Y��g��![]() mZ��g������H =��akJ/mol��a>0�����мס������ݻ�����ҹ̶����ܱ��������ڱ��ָ��¶��£����ܱ���������ͨ��1molX��2molY����ƽ��״̬ʱ���ų�����bkJ�����ܱ���������ͨ��2molX��4molY����ƽ��״̬ʱ���ų�����ckJ����2b < c�������и�ֵ��ϵ��ȷ����
mZ��g������H =��akJ/mol��a>0�����мס������ݻ�����ҹ̶����ܱ��������ڱ��ָ��¶��£����ܱ���������ͨ��1molX��2molY����ƽ��״̬ʱ���ų�����bkJ�����ܱ���������ͨ��2molX��4molY����ƽ��״̬ʱ���ų�����ckJ����2b < c�������и�ֵ��ϵ��ȷ����
A. a = b B. 2a < c C. m > 3 D. m < 3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ������������еļ��֣�K+��NO![]() ��SO
��SO![]() ��NH
��NH![]() ��CO
��CO![]() ����������Һ��������H+��OH������ȡ200mL����Һ����Ϊ���ȷݽ�������ʵ�飺
����������Һ��������H+��OH������ȡ200mL����Һ����Ϊ���ȷݽ�������ʵ�飺
ʵ��1����һ�ݼ����������ռ���ȣ������������ڱ�״����Ϊ224mL������֪NH4+�ڼ��������¿�������������
ʵ��2���ڶ����ȼ������������ᣬ�������ټ���������BaCl2��Һ���ù���2.33g��
����˵����ȷ����( )
A. ����Һ����ȷ���Ƿ���K+
B. ����Һ�п϶�����NO![]() ��SO
��SO![]() ��NH
��NH![]() ��CO
��CO![]()
C. ����ȷ������Һ���Ƿ���NO![]()
D. ����Һ��һ����K+����c(K+)= 0.1mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LiH2PO4���Ʊ���ص���Ҫԭ�ϡ������£�LiH2PO4��Һ��pH��c��ʼ��H2PO4�C���ı仯��ͼ1��ʾ��H3PO4��Һ��H2PO4�C�ķֲ�����![]() ��pH�ı仯��ͼ2��ʾ��
��pH�ı仯��ͼ2��ʾ��![]() �����й�LiH2PO4��Һ��������ȷ����
�����й�LiH2PO4��Һ��������ȷ����
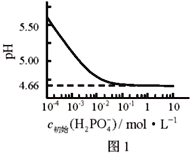
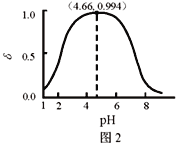
A. ��PԪ�ص�������H2PO4�C��HPO42�C��PO43�C
B. LiH2PO4��Һ�д���2��ƽ��
C. ��Ũ�ȴ���1 mol��L-1��H3PO4��Һ�ܽ�Li2CO3����pH�ﵽ4.66ʱ��H3PO4����ȫ��ת��ΪLiH2PO4
D. ��c��ʼ��H2PO4�C��������Һ��pH���Ա�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪pOH=-lgc(OH-)��T��ʱ����50mL0.1mol��L��1MOH��Һ�еμ�0.1mol��L��1���ᣬ��ҺpH��pOH�������������ı仯����ͼ��ʾ������˵����ȷ����
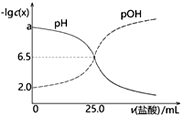
A. ������MOH��Һǡ���к�ʱ��ҺpH=6.5
B. a=12
C. ����ζ�MOHʵ����ѡ���̪��ָʾ����ѡ��������С
D. T��ʱ��MOH�ĵ���ƽ�ⳣ��KbԼΪ1.0��10-3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X��Y�γ��ܹ����ӻ�����XY2���Ҹ����ӻ����������������Ӿ�����ͬ�ĵ��Ӳ�ṹ������˵������ȷ���ǣ� ��
A.���Ӱ뾶��X2+��Y-
B.ԭ��������X��Y
C.�û�������ֻ�������Ӽ�
D.ԭ������������X��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��������ݻ���ͬ�ĺ����ܱ������а���ͬ�ķ�ʽͶ�뷴Ӧ�������Ӧ N2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4kJ/mol,��÷�Ӧ������������±�:
2NH3(g) ��H=-92.4kJ/mol,��÷�Ӧ������������±�:
������ | ������ | ������ | |
��Ӧ�¶�/�� | 400 | 400 | 500 |
��Ӧ��Ͷ���� | 1molN2��3molH2 | 4molNH3 | 1molN2��3molH2 |
ƽ��ʱv(��)(H2)/mol/(Ls) | v1 | v2 | v3 |
ƽ��ʱc(NH3)/(mol/L) | c1 | c2 | c3 |
ƽ��ʱ��ѹǿP/Pa | P1 | P2 | P3 |
���ʵ�ƽ��ת����a | a1(N2) | a2(NH3) | a3(N2) |
ƽ�ⳣ��K | K1 | K2 | K3 |
���й�ϵ��ȷ����
A. v1<v2��c1<2c2 B. c2>2c3��a2(NH3)+a3(N2)<1
C. K1>K3�� P2>2P3 D. v1<v3��a1(N2)<a3(N2)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com