
【题目】无水氯化锌是有机合成中重要催化剂,无水氯化锌为白色粉末,易潮解,沸点为732℃。久置市售氯化锌常含Zn(OH)Cl,影响催化效果。实验室用HC1气体“置换”除水、升华氯化锌相结合的方法提纯市售氯化锌。
(1)选用下图所示的装置(可以重复选用)进行实验,装置接口依次连接的合理顺序为:a→___________。
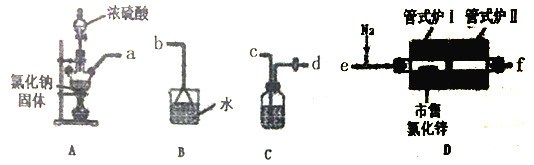
(2)装置A盛氯化钠固体的仪器名称是___________,装置C中试剂是___________。
(3)实验开始时,通入HC1和N2,将管式炉I,Ⅱ升温至150℃,装置D中发生的化学反应方程式为___________;此时通入N2的目的是______________________;
(4)反应一段时间后保持管式炉I、Ⅱ温度为350℃,保证将水除尽,再______________________;(填操作)最后在氮气保护下将氯化锌刮出玻璃管外,保存待用。
(5)若称取100.00g市售氯化锌样品,经提纯最终得到高纯氯化锌100.3g,则样品中氯化锌纯度为___________。
【答案】(cd)efcdb 三颈烧瓶 浓硫酸 Zn(OH)2Cl+HCl![]() ZnCl2+H2O 稀释HCl气体,提供惰性环境 撤去管式炉Ⅱ,将管式炉Ⅰ升温至732℃以上 73.1%
ZnCl2+H2O 稀释HCl气体,提供惰性环境 撤去管式炉Ⅱ,将管式炉Ⅰ升温至732℃以上 73.1%
【解析】
根据实验目的,利用浓硫酸的高沸点、酸性,氯化钠固体、浓硫酸加热反应生成HCl,用浓硫酸干燥氯化氢;氯化锌升华进入管式炉Ⅱ,凝华得到高纯度无水氯化锌;为了防止氯化锌吸水潮解,在完全吸收装置前应该增加一个干燥装置,据此进行解答。
(1)A装置制取HCl,经C装置干燥后通入D中,将反应后的尾气经C装置干燥后,再用B装置吸收未反应的HCl气体;
(2) 根据仪器的结构和性能确定仪器的名称,装置C的作用是干燥HCl气体;
(3)在加热条件下装置D中Zn(OH)Cl和HCl反应生成ZnCl2和水;HCl中添加适量氮气可稀释HCl气体,另外氮气的性质稳定;
(4) 氯化锌升华进入管式炉Ⅱ,凝华得到高纯度无水氯化锌,所以实验时应该先撤去管式炉Ⅱ;
(5)根据差量法计算样品中氯化锌纯度。
(1)A装置制取HCl,经C装置干燥后通入D中,将反应后的尾气再通过C装置,以防CB装置中的水蒸气引起氯化锌水解,最后用B装置吸收未反应的HCl气体,则装置接口依次连接的合理顺序为acdefcdb;
(2)根据仪器的结构和性能确定仪器的名称是三颈烧瓶,装置C的作用是干燥HCl气体,则盛装的试剂为浓硫酸;
(3) 在加热条件下装置D中Zn(OH)Cl和HCl反应生成ZnCl2和水,发生反应的化学方程式为Zn(OH)2Cl+HCl![]() ZnCl2+H2O;实验中通入HC1和N2,其中通入N2的目的是稀释HCl气体,并提供惰性环境,防ZnCl2被氧化;
ZnCl2+H2O;实验中通入HC1和N2,其中通入N2的目的是稀释HCl气体,并提供惰性环境,防ZnCl2被氧化;
(4) 氯化锌升华进入管式炉Ⅱ,凝华得到高纯度无水氯化锌,所以实验时应该先撤去管式炉Ⅱ的加热,则反应一段时间后保持管式炉I、Ⅱ温度为350℃,保证将水除尽,再撤去管式炉Ⅱ,将管式炉Ⅰ升温至732℃以上;
(5)设样品中含有Zn(OH)2Cl的质量为mg,则
Zn(OH)2Cl+HCl![]() ZnCl2+H2O △m
ZnCl2+H2O △m
134.5 136 1.5
mg 100.3.g-100g=0.3g
![]() 解得:m=26.9,则样品中氯化锌纯度为
解得:m=26.9,则样品中氯化锌纯度为![]() =73.1%。
=73.1%。


科目:高中化学 来源: 题型:
【题目】已知苯乙烯的结构为![]() 。有关该物质的下列说法正确的是( )
。有关该物质的下列说法正确的是( )
A. 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物 6 种
B. 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同
C. 苯乙烯分子的所有原子不可能在同一平面上
D. 除去乙苯中混有的苯乙烯可以通入等量氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A.把CaCl2放入水中:CaCl2===Cu2++Cl2-
B.把NaHSO4放入水中:NaHSO4===Na++H++SO![]()
C.把Ba(OH)2放入水中:Ba(OH)2=== Ba 2++(OH)2-
D.把H2SO4放入水中:H2SO4=== H2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验描述正确的是
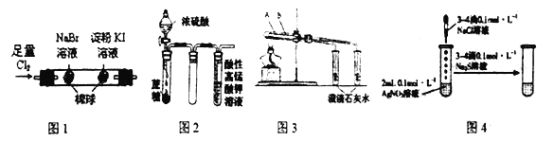
A. 图1:左边棉花变为橙色,右边棉花变为蓝色,还原性:C1-<Br-<I-
B. 图2:酸性KMnO4溶液中出现气泡,但颜色无变化
C. 图3:可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体
D. 图4:试管中先有白色沉淀、后有黑色沉淀生成,能确定Ksp(AgCl)>ksp(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 在一定条件,化合物Y可与HCHO发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界前列,钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化生成X和Y(少量),X和Y中Mo价态相同,硝酸本身被还原为NO2,该反应中氧化剂与还原剂的物质的量之比为6:1,则Mo在氧化产物中的化合价为___________;
(2)已知:2Mo(s)+3O2(g)===2MoO3(s) △H1;
MoS2(s)+2O2(g)===Mo(s)+2SO2(g) △H2。
写出MoS2(s)与氧气反应生成MoO3(s)的热化学方程式_____________________________;
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为
MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO (g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
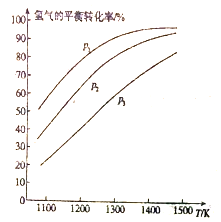
(a)不同压强下温度与H2平衡转化率的关系

(b)0.1MPa下温度与平衡时气体成分的关系
①由图(a)可知,该反应△H___________0(填“>”或“<”),p1、p2、p3由大到小的顺序为___________;
②由图(b)可知,B点时H2的平衡转化率为___________;
③A点对应的平衡常数K=___________(MPa)2。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-。
①辉钼矿应放入电解槽的___________(填“阴极区”或“阳极区”);
②阴极的电极反应式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A~J均为有机化合物,根据图中的信息,回答下列问题。
已知:分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生反应:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为_______________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为__________________________________。
(3)由E和A反应生成F的化学方程式为___________________________________。
(4)D中含有的官能团是________,由H生成I的反应类型是______________
(5)已知:R-COOH+NaOH→R-COONa+H2O,G的分子式为C6H10O4,0.146gG需用20mL0.100mol·L-1 NaOH溶液完全中和,G的结构简式为______________________;
(6)![]() 为重要的化工原料,根据题中信息,设计以1,3-丁二烯为原料合成
为重要的化工原料,根据题中信息,设计以1,3-丁二烯为原料合成![]() 的合成路线_____________________________(以流程图形式表示,无机试剂任选)。
的合成路线_____________________________(以流程图形式表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.甲乙两池电极材料均为铁棒与铂棒,请回答下列问题:

(1)若电池中均为CuSO4溶液,则下列说法正确的是___________
A.一段时间后,甲乙两池中Pt棒上都有红色物质析出
B.甲池中Fe棒上发生氧化反应,乙池中Fe棒上发生还原反应
C.甲池中Cu2+向Fe棒移动,乙池中Cu2+向Pt棒移动
D.一段时间后,甲池中Fe棒质量减少,乙池中Fe棒质量增加
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式_____________________________________,乙池中Pt棒上的电极反应属于_______反应(填“氧化”或是“还原”)
②甲池中Pt棒上的电极反应式是_______________________________________
③室温下,若乙池转移0.02mol电子后停止实验,该池中溶液体积为2000mL,则溶液混合均匀后pH=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com