
����Ŀ��ͼ��A��J��Ϊ�л����������ͼ�е���Ϣ���ش��������⡣
��֪�������к�������̼̼˫����������˫��֮����һ��̼̼������ϩ���뵥ϩ���ɷ�����Ӧ��
��1����״������A����Է�������Ϊ82�����к�̼87.80%������12.2%��B��һ�ȴ������һ�֣�B�Ľṹ��ʽΪ_______________________��
��2��M��B��һ��ͬ���칹�壬M��ʹ������Ȼ�̼��Һ��ɫ�����������е�̼ԭ�ӹ�ƽ�棬��M�Ľṹ��ʽΪ__________________________________��
��3����E��A��Ӧ����F�Ļ�ѧ����ʽΪ___________________________________��
��4��D�к��еĹ�������________����H����I�ķ�Ӧ������______________
��5����֪��R-COOH+NaOH��R-COONa+H2O��G�ķ���ʽΪC6H10O4,0.146gG����20mL0.100mol��L��1 NaOH��Һ��ȫ�кͣ�G�Ľṹ��ʽΪ______________________��
��6��![]() Ϊ��Ҫ�Ļ���ԭ�ϣ�����������Ϣ�������1,3-����ϩΪԭ�Ϻϳ�
Ϊ��Ҫ�Ļ���ԭ�ϣ�����������Ϣ�������1,3-����ϩΪԭ�Ϻϳ�![]() �ĺϳ�·��_____________________________��������ͼ��ʽ��ʾ�����Լ���ѡ����
�ĺϳ�·��_____________________________��������ͼ��ʽ��ʾ�����Լ���ѡ����
���𰸡�![]()
![]()
![]() +
+![]()
![]()
![]() ��ԭ�� ȡ����Ӧ����ˮ�ⷴӦ�� HOOC��CH2��4COOH CH2=CH-CH=CH2
��ԭ�� ȡ����Ӧ����ˮ�ⷴӦ�� HOOC��CH2��4COOH CH2=CH-CH=CH2![]() BrCH2-CH=CH-CH2Br
BrCH2-CH=CH-CH2Br![]()
![]()
![]()
![]()
��������
����A��̼�⺬��֪A������A��̼ԭ�Ӹ���=![]() =6����ԭ�Ӹ���=
=6����ԭ�Ӹ���=![]() =10������A�ķ���ʽΪC6H10��A�ܺ����������ӳɷ�Ӧ����B��˵��A�к���̼̼˫����B��һ�ȴ������һ�֣�˵��������Bû��֧��������A�Ľṹ��ʽΪ
=10������A�ķ���ʽΪC6H10��A�ܺ����������ӳɷ�Ӧ����B��˵��A�к���̼̼˫����B��һ�ȴ������һ�֣�˵��������Bû��֧��������A�Ľṹ��ʽΪ![]() ��B�Ľṹ��ʽΪ��
��B�Ľṹ��ʽΪ��![]() ��A���巢���ӳɷ�Ӧ����D��DΪ
��A���巢���ӳɷ�Ӧ����D��DΪ![]() ��D���������ƵĴ���Һ������ȥ��Ӧ����E��E�ܺ�A������Ӧ����F����������Ϣ֪��E�Ľṹ��ʽΪ��
��D���������ƵĴ���Һ������ȥ��Ӧ����E��E�ܺ�A������Ӧ����F����������Ϣ֪��E�Ľṹ��ʽΪ��![]() ��F�Ľṹ��ʽΪ��
��F�Ľṹ��ʽΪ��![]() ��F��HBr�����ӳɷ�Ӧ����H����H�Ľṹ��ʽΪ��
��F��HBr�����ӳɷ�Ӧ����H����H�Ľṹ��ʽΪ��![]() ��H���������Ƶ�ˮ��Һ����ȡ����Ӧ����I��I�Ľṹ��ʽΪ��
��H���������Ƶ�ˮ��Һ����ȡ����Ӧ����I��I�Ľṹ��ʽΪ��![]() ��A�����Ը��������������G��̼̼˫���ܱ����Ը�����������������ᣬG�ķ���ʽΪC6H10O4��0.146gG�����ʵ���=
��A�����Ը��������������G��̼̼˫���ܱ����Ը�����������������ᣬG�ķ���ʽΪC6H10O4��0.146gG�����ʵ���=![]() =0.001mol��20mL0.100mol/L NaOH�����ʵ���=0.100mol/L��0.02L=0.002mol������G�к��������Ȼ�����ṹ��ʽΪ��HOOC(CH2)4COOH���ݴ˷������
=0.001mol��20mL0.100mol/L NaOH�����ʵ���=0.100mol/L��0.02L=0.002mol������G�к��������Ȼ�����ṹ��ʽΪ��HOOC(CH2)4COOH���ݴ˷������
(1)ͨ�����Ϸ���֪��B�Ľṹ��ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(2)M��B��һ��ͬ���칹�壬M��ʹ������Ȼ�̼��Һ��ɫ��˵������̼̼˫�������������е�̼ԭ�ӹ�ƽ�棬��M�е�̼̼˫��λ���м䣬�൱����ϩ�е���ԭ�ӱ���ȡ����������M�Ľṹ��ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
(3)E��A�����Ӿ۷�Ӧ����F���÷�Ӧ����ʽΪ��![]() +
+![]()
![]()
![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() +
+![]()
![]()
![]() ��
��
(4)DΪ![]() �����еĹ�����Ϊ��ԭ�ӣ�����������������H����IΪ±������ˮ�ⷴӦ��Ҳ����ȡ����Ӧ���ʴ�Ϊ����ԭ�ӣ�ȡ����Ӧ(��ˮ�ⷴӦ)��
�����еĹ�����Ϊ��ԭ�ӣ�����������������H����IΪ±������ˮ�ⷴӦ��Ҳ����ȡ����Ӧ���ʴ�Ϊ����ԭ�ӣ�ȡ����Ӧ(��ˮ�ⷴӦ)��
(5)��������������G�Ľṹ��ʽΪHOOC(CH2)4COOH���ʴ�Ϊ��HOOC(CH2)4COOH��
(6)��1��3-����ϩΪԭ�Ϻϳ�![]() �����������Ϣ�������к�������̼̼˫����������˫��֮����һ��̼̼������ϩ���뵥ϩ���ɷ�����Ӧ��
�����������Ϣ�������к�������̼̼˫����������˫��֮����һ��̼̼������ϩ���뵥ϩ���ɷ�����Ӧ��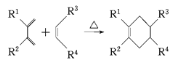 ���������Ⱥϳ�BrCH2-CH=CH-CH2Br��Ȼ��1��3-����ϩ��BrCH2-CH=CH-CH2Br������Ӧ����
���������Ⱥϳ�BrCH2-CH=CH-CH2Br��Ȼ��1��3-����ϩ��BrCH2-CH=CH-CH2Br������Ӧ����![]() ��
��![]() ˮ�⼴�ɣ��ϳ�·��ΪCH2=CH-CH=CH2
ˮ�⼴�ɣ��ϳ�·��ΪCH2=CH-CH=CH2![]() BrCH2-CH=CH-CH2Br
BrCH2-CH=CH-CH2Br![]()
![]()
![]()
![]() ���ʴ�Ϊ��CH2=CH-CH=CH2
���ʴ�Ϊ��CH2=CH-CH=CH2![]() BrCH2-CH=CH-CH2Br
BrCH2-CH=CH-CH2Br![]()
![]()
![]()
![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2�����ǰ�ȫ��������ɫ�������ͱ��ʼ���ʹ���в������°��P������Ⱦ�ij��ѧ��ȤС��ͨ����ͼ�������ա��ͷŽ����о�����ش��������⣺
(1)��KClO3��Na2SO3��H2SO4�ữʱ��ȡClO2���÷�Ӧ�����ӷ���ʽΪ______��
(2)��ͼA��ʢ����Na2CO3-H2O2�����Һ��������ClO2�������ȶ�������֪ClO2���ȶ�����������NaClO2����C�е���KI-H2SO4��Һ������_____(������������������) ˵��������A��ClO2����ȫ���ա�
(3)��֪ClO2�����������ǵ����ʵ���Cl2��2.5������ClO2�ڽ������Һ�е�CN��������CO2��N2�ķ�Ӧ�У��������ͻ�ԭ�������ʵ���֮��Ϊ______��
(4)��B��A�еμ�ϡ���ἴ���ͷų�ClO2����ʱC��������_____����֪ClO2�ܱ������ȶ��������գ�����ClO2���ڹ��߱��ʣ�ͼ������Ч���Ϻõ��ȶ�����___(�� ������������)��ԭ����______��

(5)ClO2�ġ���Ч�ȡ���ͨ���궨��Ӧ����Һ�еIJ��ȣ�c(Cl-)�����ⶨ���ڷ�����ѧ����K2CrO4Ϊָʾ������AgNO3����Һ�ζ���Һ�е�Cl-��������ש��ɫ����ʱ����ָʾ��ζ��յ㡣����֤��Һ��c(Cl-)��Ϊ1.0��10-5 mol/L�����ʱ��Һ��c(CrO42-)Ӧ������______mol/L����Ksp(AgCl)=2.0��10��10��Ksp(Ag2CrO4)=2.0��10-12�ݡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ǣ�������
A. ���ʱ�����ƵĽ�����Ʒ������
B. �ö��Ե缫���CuSO4��Һ����ҺpH����
C. ����ȼ�ϵ�أ����Ե���ʣ��У�������ӦΪO2+4H++4e��=2H2O
D. ��п��Ƥ�ȶ�����Ƥ��ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
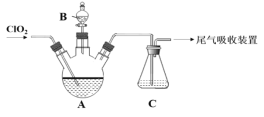
����Ŀ����ˮ�Ȼ�п���л��ϳ�����Ҫ��������ˮ�Ȼ�пΪ��ɫ��ĩ���׳��⣬�е�Ϊ732�档���������Ȼ�п����Zn(OH)Cl��Ӱ���Ч����ʵ������HC1���塰�û�����ˮ�������Ȼ�п���ϵķ����ᴿ�����Ȼ�п��
(1)ѡ����ͼ��ʾ��װ��(�����ظ�ѡ��)����ʵ�飬װ�ýӿ��������ӵĺ���˳��Ϊ��a��___________��
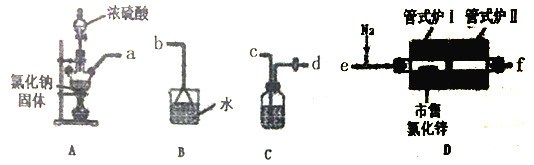
(2)װ��Aʢ�Ȼ��ƹ��������������___________��װ��C���Լ���___________��
(3)ʵ�鿪ʼʱ��ͨ��HC1��N2������ʽ¯I����������150�棬װ��D�з����Ļ�ѧ��Ӧ����ʽΪ___________����ʱͨ��N2��Ŀ����______________________��
(4)��Ӧһ��ʱ��ֹ�ʽ¯I�����¶�Ϊ350�棬��֤��ˮ��������______________________��(�����)����ڵ��������½��Ȼ�п�γ��������⣬������á�
(5)����ȡ100.00g�����Ȼ�п��Ʒ�����ᴿ���յõ��ߴ��Ȼ�п100.3g������Ʒ���Ȼ�п����Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ����һ����Ҫ����Դ��ͨ��ʯ�ͷ���ɵõ����ͣ�������Ϊԭ�ϣ��ɺϳ�X��CH3COOCH=CH2������A�����ϩ����B�ܷ���������Ӧ��D����Է���������AС2����ش������й����⣺

(1)A�еĹ�����������___________________
(2)B��C�Ļ�ѧ����ʽ_____________________________
(3)��֪C��D�����ӳɷ�Ӧ����X���仯ѧ����ʽΪ________________________
(4)����˵����ȷ����_____
A���˴��ġ�ij���ա�ָ���Ƿ��� B��B��һ���������������������ӳɷ�Ӧ
C��X������ˮ����ʹ���Ը��������Һ��ɫ D������������Ȼ�̼��Һ����A��D
(5)F��X��ͬ���칹�壬1molF����4molAg(NH3)2OH��Ӧ��д��F���ܵĽṹ��ʽ_____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)��һ����ˮ�����ȷ����й㷺Ӧ�õĸ�Ч��ȫ��������Cl2��ȣ�ClO2�������и�������ɱ�����������Ҳ��������������DZ��Σ�����л��ȴ���Ʊ�ClO2���������ַ�����
����һ��2NaClO3+4HCl=2ClO2��+Cl2��+2NaCl+2H2O
��������2NaClO3+H2O2+H2SO4=2ClO2��+O2��+Na2SO4+2H2O
��1������һ�����ӷ���ʽΪ______________________________��
��2���������б�������������_______������Ӧ����0.1 mol����ת�ƣ��������ClO2�����ڱ�״���µ����Ϊ_________L��
��3����˫���ŷ��������һ�з���ʽ����ת�Ƶķ������Ŀ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ˮ�������ϸ��¶ȣ�Kw���pH��С��������
B. �����£���pH=4�Ĵ�����Һϡ�ͺ���Һ���������ӵ�Ũ�Ⱦ�����
C. ��0.1 mol��L-1������Һ�м������������ᣬ��Һ��pH��С���������̶ȱ��
D. �������pH��Ϊ3����HA��HB�ֱ���������Zn��Ӧ��HA�ų���H2�࣬˵��HA������С��HB
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī�缫����������ʣ������缫�϶��������������( )
A.����ʳ��ˮB.�Ȼ�ͭ��ҺC.����������D.�����Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪pOH=-lgc(OH-)��T��ʱ����50mL0.1mol��L��1MOH��Һ�еμ�0.1mol��L��1���ᣬ��ҺpH��pOH�������������ı仯����ͼ��ʾ������˵����ȷ����
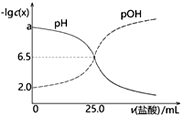
A. ������MOH��Һǡ���к�ʱ��ҺpH=6.5
B. a=12
C. ����ζ�MOHʵ����ѡ���̪��ָʾ����ѡ��������С
D. T��ʱ��MOH�ĵ���ƽ�ⳣ��KbԼΪ1.0��10-3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com