
【题目】已知pOH=-lgc(OH-)。T℃时,往50mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
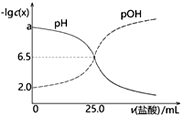
A. 盐酸与MOH溶液恰好中和时溶液pH=6.5
B. a=12
C. 盐酸滴定MOH实验中选择酚酞做指示剂比选甲基橙误差更小
D. T℃时,MOH的电离平衡常数Kb约为1.0×10-3
【答案】D
【解析】
A. 据图可知,pH=pOH=6.5时,溶液呈中性,MOH的起始pOH为2.0,而MOH的浓度为0.1mol/L,说明MOH是一元弱碱,HCl是一元强酸,恰好中和时生成MCl,MCl发生水解使溶液呈酸性,所以pH<6.5,故A错误;
B. 溶液中c(H+)=c(OH),即pH=pOH时,溶液显中性,根据图象可知pH=6.5时溶液为中性,则T℃时有pKw=pH+pOH=6.5+6.5=13,所以a的值为a=132=11,故B错误;
C. 由上述分析可知,盐酸滴定MOH恰好中和时得到MCl溶液,MCl发生水解使溶液呈酸性,所以应选择甲基橙作指示剂,故C错误;
D. T℃时,0.1mol·L-1MOH溶液的pOH值为2.0,即c(OH)=102mol/L,则其Kb=![]() =
=![]() ≈1.0×103,故D正确,答案选D。
≈1.0×103,故D正确,答案选D。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】图中A~J均为有机化合物,根据图中的信息,回答下列问题。
已知:分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生反应:
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为_______________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为__________________________________。
(3)由E和A反应生成F的化学方程式为___________________________________。
(4)D中含有的官能团是________,由H生成I的反应类型是______________
(5)已知:R-COOH+NaOH→R-COONa+H2O,G的分子式为C6H10O4,0.146gG需用20mL0.100mol·L-1 NaOH溶液完全中和,G的结构简式为______________________;
(6)![]() 为重要的化工原料,根据题中信息,设计以1,3-丁二烯为原料合成
为重要的化工原料,根据题中信息,设计以1,3-丁二烯为原料合成![]() 的合成路线_____________________________(以流程图形式表示,无机试剂任选)。
的合成路线_____________________________(以流程图形式表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:①![]()
②![]()
③![]()
试据此写出一氧化碳燃烧的热化学方程式___________________________。
Ⅱ.甲乙两池电极材料均为铁棒与铂棒,请回答下列问题:

(1)若电池中均为CuSO4溶液,则下列说法正确的是___________
A.一段时间后,甲乙两池中Pt棒上都有红色物质析出
B.甲池中Fe棒上发生氧化反应,乙池中Fe棒上发生还原反应
C.甲池中Cu2+向Fe棒移动,乙池中Cu2+向Pt棒移动
D.一段时间后,甲池中Fe棒质量减少,乙池中Fe棒质量增加
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式_____________________________________,乙池中Pt棒上的电极反应属于_______反应(填“氧化”或是“还原”)
②甲池中Pt棒上的电极反应式是_______________________________________
③室温下,若乙池转移0.02mol电子后停止实验,该池中溶液体积为2000mL,则溶液混合均匀后pH=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、 向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色。
查阅资料知,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)用双线桥法表示过程①电子转移情况:H2O2+2KI+H2SO4=I2+K2SO4+2H2O_____________。
(2)只比较上述反应②与③,则判断I2起到了___________的作用。
(3)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱:___________(填化学式)。
II、一定条件下,向含硝酸的废水中加入CH3OH(碳元素为-2价),将HNO3还原成N2。若参加反应的还原剂和氧化剂的物质的量之比是5∶6,则该反应中被氧化的元素的化合价为_____;每转移3 mol电子,反应消耗_____g CH3OH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2 ;
2PbO+2SO2 ;
③制粗铅:PbO+C![]() Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法错误的是
A. 浮选法富集方铅矿的过程属于物理变化
B. 将lmol PbS冶炼成Pb理论上至少需要6g碳
C. 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
D. 培烧过程中,每生成lmol PbO转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为_____________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g) ΔH>0,请你分析该设想能否实现并说明理由是____________________________________________。
(3)甲酸的电离平衡常数Ka=1.70×10-4。向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为______________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
(5)工业生产尾气中的CO2捕获技术之一是氨水溶液吸收技术,工艺流程是将烟气冷却至15.5~26.5℃后用氨水吸收过量的CO2,该反应的化学方程式为_______________________。在用氨水吸收前,烟气需冷却至15.5~26.5℃的可能原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列反应原理的离子方程式正确的是
A. 用加热的方法降低自来水中钙离子浓度:Ca2++2HCO3-![]() CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
B. 向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH-→CH2BrCOO-+H2O
C. 向Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+H2O
D. 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为从海带中提碘生产的实验室模拟流程。试回答下列问题:
(1)实验操作中所用玻璃仪器为酒精灯、烧杯、普通漏斗、牛角管、锥形瓶、蒸馏烧瓶等。若要完成操作1,还缺少的玻璃仪器有 ,该仪器的作用为 ;操作2的名称为 ;若要完成操作3,还缺少的玻璃仪器有 。
(2)实验室用二氧化锰制氯气的化学方程式为 。
(3)弃液B中滴入淀粉液,溶液呈蓝色,但通入二氧化硫后蓝色褪去,写出该过程中发生反应的化学方程式并用双线桥标明电子转移的方向和数目 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com