
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀法除去。已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-:Cr3++3OH ![]() Cr(OH)3
Cr(OH)3 ![]() CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
CrO2-+H++H2O。②CrO2-还原产物为Cr3+。③ lg3.3=0.50。请回答下列问题:
(1)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=__________。
(2)常温下,向50 mL 0.05 mol·L1的Cr2(SO4)3溶液中加入1.0 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为____________。
(3)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定终点的现象是__________________。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(4)Na2Cr2O7的含量也可以用一定难度的NaNO2溶液进行滴定。已知常温下HNO2的电离常数Ka=7.1×10-4 ,NH3·H2O的电离常数Kb=1.7×10-5 。0.1 mol·L-1 NH4NO2溶液中各离子浓度由大到小的顺序是______________________。
【答案】1.0×10-32 13.5 酸式 溶液显紫色 ![]() c(NO2-)>c(NH4+)>c(H+)>c(OH-)
c(NO2-)>c(NH4+)>c(H+)>c(OH-)
【解析】
(1)Cr3+完全沉淀(c≤1.0×10-5 mol/L) 时,溶液的pH为5,据此计算Cr(OH)3的溶度积常数;
(2)50mL 0.05mol/L的Cr2(SO4)3溶液中加入1.0mol/L的NaOH溶液50mL,则混合后溶液中c(Cr3+)=0.05mol/L,c(OH-)=0.5mol/L,发生反应:Cr3++3OH-═Cr(OH)3,根据方程式计算;
(3)①酸性高猛酸钾溶液,具有强氧化性,需选用酸式滴定管,滴定终点的现象是溶液显紫色;
②根据氧化还原反应,结合电子得失守恒关系进行相关计算;
(4)根据NH4+和NO2-的水解程度相对大小判断NH4NO2的酸碱性,再根据电荷守恒分析离子浓度大小,根据HNO2的电离平衡常数计算NO2-的水解常数。
(1)常温下,Cr3+完全沉淀(c1.0×105 mol/L) 时,溶液的pH为5,溶液中c(OH)=109mol/L,c(Cr3+)=105mol/L,则常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=c(Cr3+)c3(OH)=1.0×1032;
故答案为:1.0×10-32;
(2)50mL 0.05mol/L的Cr2(SO4)3溶液中加入1.0mol/L的NaOH溶液50mL,则混合后溶液中c(Cr3+)=0.05mol/L,c(OH)=0.5mol/L,发生反应:Cr3++3OH═Cr(OH)3,则反应后c(OH)=0.5mol/L0.15mol/L=0.35mol/L,所以充分反应后,溶液pH=14pOH=14+lgc(OH)=13.5;
故答案为:13.5;
(3)①步骤Ⅱ中所用的标准液为酸性高猛酸钾溶液,具有强氧化性,需选用酸式滴定管,滴定终点的现象是溶液显紫色;
故答案为:酸式;溶液显紫色;
②c mol/L的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL,Mn从+7价降为+2价,Fe从+2价升为+3价,根据电子得失守恒,存在反应关系:MnO45Fe2+,则滴定所用的FeSO4的浓度为c(Fe2+)=5cmol/L,取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液,Cr从+6价降为+3价,Fe从+2价升为+3价,根据电子得失守恒,存在反应关系:Cr2O726Fe2+,则bmL溶液中Na2Cr2O7的含量为![]() ;
;
故答案为:![]() ;
;
(4)NH4+的水解平衡常数为Kh(NH4+)= ![]() =5.88×1010,NO2的水解平衡常数为Kh=
=5.88×1010,NO2的水解平衡常数为Kh= ![]() =1.4×1011,可见NH4+水解程度相对较大,所以溶液呈酸性,c(H+)>c(OH-),根据电荷守恒:c(NH4+)+c(H+)=c(OH)+c(NO2),则有c(NO2-)>c(NH4+)>c(H+)>c(OH-);
=1.4×1011,可见NH4+水解程度相对较大,所以溶液呈酸性,c(H+)>c(OH-),根据电荷守恒:c(NH4+)+c(H+)=c(OH)+c(NO2),则有c(NO2-)>c(NH4+)>c(H+)>c(OH-);
故答案为:c(NO2-)>c(NH4+)>c(H+)>c(OH-)。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() 的σ键和π键比例为4:1
的σ键和π键比例为4:1
B.某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C.Na、P、Cl的电负性依次增大
D.CH3CH(OH)COOH分子中有手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()
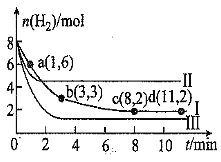
A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各种微粒浓度大小关系或结论正确的是( )
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性: ![]()
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(H+)=2c(OH-)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
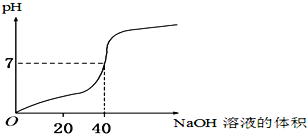
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下0.1 mol/L的NaHB(强电解质)溶液中c(H+)>c(OH-),则下列关系一定正确的是( )
A. c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B. c(Na+)=0.1 mol/L≥c(B2-)
C. HB-的水解方程式为HB-+H2O![]() B2-+H3O+
B2-+H3O+
D. 在该盐的溶液中,离子浓度大小顺序为c(Na+)>c(HB-)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NO+NO2+2NaOH═2NaNO2+H2O;2NO2+2NaOH═NaNO3+NaNO2+H2O。将总体积共为40 mL的NO和O2两种气体分别同时通入同一足量的NaOH溶液中,完全反应后,溶液中只含有NaNO2和NaOH,剩余气体5 mL,则原混合气体中NO的体积为( )
A.20 mLB.25 mLC.12 mLD.33 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5,该温度下,用0.100mol·L-1的氨水滴定10.00mL0.100mol·L-1的一元酸HA的溶液,滴定过程中加入氨水的体积(V)与溶液中lg![]() 的关系如右图所示。下列说法不正确的是
的关系如右图所示。下列说法不正确的是
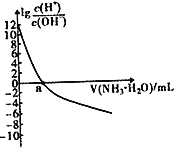
A. a=10 B. HA为强酸
C. 25℃时,NH4+的水解平衡常数为![]() ×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
×10-9 D. 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com