
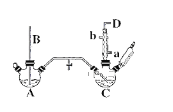
【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
苯 | 78 | 78 | 0.88 |
氯苯 | 112.5 | 132.2 | 1.1 |
邻二氯苯 | 147 | 180.4 | 1.3 |
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式。_______________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______________,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。
【答案】平衡气压 ![]() 温度过高,苯挥发,原料利用率不高 Cl2、HCl、苯蒸气 吸水干燥 39% 2
温度过高,苯挥发,原料利用率不高 Cl2、HCl、苯蒸气 吸水干燥 39% 2![]() + 2HCl + O2
+ 2HCl + O2![]() 2
2![]() +2H2O
+2H2O
【解析】
(1)、玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;
(2)、根据氯气、苯、铁屑作为反应物书写方程式;
(3)、把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,温度过高,苯挥发,由于苯易挥发,反应产生的HCl,且有未反应的氯气,都会在D出口导出;
(4)、氯化液水洗、碱洗出去杂质,加入无水CaCl2吸水干燥,过滤后的滤液蒸馏、精馏得到产品;
(5)、![]() ;
;
(6)、苯气相氧氯化氢法制氯苯:空气、氯化氢气混合物温度210°C,进入氯化反应器,在迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化生成氯苯和水。
(1)、A反应器是利用实验室法制取氯气,反应原理为: MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;
MnCl2+Cl2↑+2H2O,玻璃管B伸入液面下,装置内压强过大时,可以用于平衡气压;
故答案为:平衡气压;
(2)、根据氯气、苯、铁屑作为反应物书写方程式为: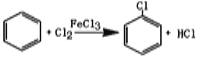 ;
;
(3)、把干燥的氯气通入装有干燥苯的反应器C中制备氯苯,C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②温度过高,苯挥发,原料利用率不高,由于苯易挥发,反应产生的HCl,且有未反应的氯气,D出口气体中含有HCl、苯蒸汽、氯气;
(4)、氯化钙易吸水,净化过程中加入无水CaCl2的目的是吸水干燥,故答案为:吸水干燥;
(5)、在C三口烧瓶中加入50.0mL苯(含催化剂FeCl3),密度0.88g/mL,苯的质量近似0.88g/mL×50mL=44g,反应理论上生成一氯苯质量=![]() ,实验中最终得到产品22.5mL为一氯苯,其质量=1.1g/mL×22.5mL=24.75g,产率
,实验中最终得到产品22.5mL为一氯苯,其质量=1.1g/mL×22.5mL=24.75g,产率![]() ;
;
故答案:39%;
(6)、气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯和水,反应的化学方程式为:2![]() + 2HCl + O2
+ 2HCl + O2![]() 2
2![]() +2H2O。
+2H2O。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素P的结构如图所示,其中R为烷烃基。下列关于维生素P的叙述正确的是
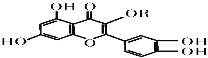
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为甲基,则该物质的分子式可以表示为C16H12O7
C.1 mol该化合物最多可消耗NaOH 为5mol
D.1 mol该化合物最多消耗溴水中的溴5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()
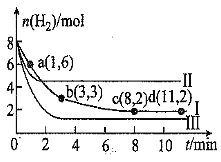
A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L恒容密闭容器中发生反应:X(g)+Y(g)2Z(g)△H<0.T℃时,各物质的物质的量与时间关系如下表:下列说法正确的是
时间/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
0 | 0.20 | 0.60 | 0 |
10 | a1 | a2 | 0.25 |
13 | b1 | 0.45 | b2 |
15 | d1 | d2 | 0.30 |
A.前10 min内的平均反应速率v(Y)=2.5×10﹣3mol/(Lmin)
B.保持其它条件不变,升高温度,反应达平衡时c(X)<5.0×10﹣3mol/L
C.若起始时只充入0.60molZ(g),反应达平衡时Z(g)的转化率为50%
D.若起始时充入0.60molX(g)、0.10molY(g)和0.50molZ(g),达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将0.1mol·L-1MgCl2溶液和0.5mol·L-1NaOH溶液等体积混合得到浊液;②取少量①中浊液,滴加0.1mol·L-1FeCl3溶液,出现红褐色沉淀;③将①中浊液过滤,取少量白色沉淀,滴加0.1mol·L-1FeCl3溶液,白色沉淀变为红褐色;④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解。下列说法中,不正确的是( )
A. 将①中所得浊液过滤,所得滤液中含少量Mg2+
B. 浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
C. 实验②和③均能说明Fe(OH)3比Mg(OH)2难溶
D. NH4Cl溶液中的NH4+可能是④中沉淀溶解的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol/L的NaOH溶液中和某浓度的H2SO4溶液,其水溶液的pH和所用NaOH溶液的体积变化关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
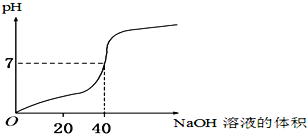
A.1.0 mol/L,20 mL B.0.5 mol/L,40 mL
C.0.5 mol/L,80 mL D.1.0 mol/L,80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有pH=1的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的某几种,现取100mL该溶液进行如下实验:根据实验结果,下列判断正确的是( )
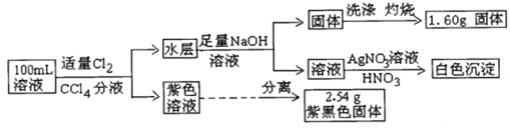
A.Fe2+,I-,Cl-三种离子一定存在B.不能确定Na+和Cl-是否存在,CO32-一定不存在
C.Fe3+与Fe2+至少有一种D.该溶液中c(Cl-)≥0.1molL-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com