
【题目】常温下,有pH=1的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的某几种,现取100mL该溶液进行如下实验:根据实验结果,下列判断正确的是( )
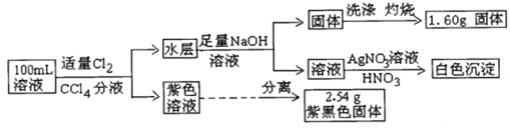
A.Fe2+,I-,Cl-三种离子一定存在B.不能确定Na+和Cl-是否存在,CO32-一定不存在
C.Fe3+与Fe2+至少有一种D.该溶液中c(Cl-)≥0.1molL-1
【答案】A
【解析】
pH=1的溶液显酸性,含有大量的H+,且n(H+)=0.1mol×0.1L=0.01mol;根据离子共存可得,原溶液中一定不含有CO32-;加入适量Cl2和CCl4分液后,得到紫色溶液,说明溶液中含有I-,根据离子共存可得,溶液中一定不含有Fe3+;紫色溶液中分离得到2.54g紫黑色固体为I2,因此可得溶液中![]() 分液后水层中加入足量NaOH溶液后,得到固体,则该固体为Fe(OH)3,则原溶液中一定含有Fe2+;固体洗涤、灼烧后得到1.60g固体,为Fe2O3,因此可得原溶液中
分液后水层中加入足量NaOH溶液后,得到固体,则该固体为Fe(OH)3,则原溶液中一定含有Fe2+;固体洗涤、灼烧后得到1.60g固体,为Fe2O3,因此可得原溶液中![]() ;根据电荷守恒可得,原溶液中一定含有Cl-,其物质的量最少为
;根据电荷守恒可得,原溶液中一定含有Cl-,其物质的量最少为![]() ;
;
A.由分析可知,溶液中一定含有Fe2+、I-和Cl-,A项正确;
B.由分析可知,溶液中一定含有Cl-, B项错误;
C.由分析可知,溶液中一定含有Fe2+,一定不含有Fe3+,C项错误;
D.由于溶液中可能含有Na+,因此溶液中所含n(Cl-)的最小量为0.03mol,其物质的量浓度![]() , D项错误;
, D项错误;
故答案为A。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
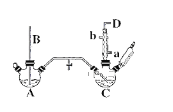
【题目】氯苯的合成工艺分为液相法和气相法两种,实验室模拟液相法的装置如下图(其中夹持仪器、加热装置及尾气处理装置已略去),有关物质的性质如表所示
名称 | 相对分子质量 | 沸点/(℃) | 密度/(g/mL) |
苯 | 78 | 78 | 0.88 |
氯苯 | 112.5 | 132.2 | 1.1 |
邻二氯苯 | 147 | 180.4 | 1.3 |
回答下列问题:
(1)A反应器是利用实验室法制取氯气,装置中中空导管B的作用是_______________。
(2)把干燥的氯气通入装有50.0mL干燥苯、少量铁屑的三颈烧瓶C中制备氯苯,写出本方法制备氯苯的化学方程式。_______________。
(3)C的反应温度不宜过高,原因为①温度过高,反应得到二氯苯;②_______________,D出口的主要尾气成分有___________________。
(4)提纯粗产品过程如下:
![]()
净化过程中加入无水CaCl2的目的是_____________。
(5)实验中最终得到产品22.5mL,产率为______________。
(6)气相法制氯苯是将空气、氯化氢气体混合物与苯在温度为210℃,迪肯型催化剂(CuCl2、FeCl3附在三氧化铝上)存在下进行氯化,发生反应生成氯苯。其反应方程式为:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃条件下将pH=12的氨水稀释过程中,下列说法正确的是___。
A.能使溶液中c(NH4+)·c(OH-)增大
B.溶液中c(H+)·c(OH-)不变
C.能使溶液中![]() 比值增大
比值增大
D.此过程中Kw增大
(2)25℃时,向0.1mol·L-1的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是____(填序号)。
①氨水与氯化铵发生化学反应
②氯化铵溶液水解显酸性,增加了c(H+)
③氯化铵溶于水,电离出大量铵离子,抑制了一水合氨的电离,使c(OH-)减小
(3)室温下,如果将0.2molNH4Cl和0.1molNaOH全部溶于水,形成混合溶液(假设无损失)。
①___和___两种粒子的物质的量之和等于0.2mol。
②____和___两种粒子的物质的量之和比OH-多0.1mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
![]()
下列说法中不正确的是( )
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图能量关系示意图,下列说法正确的是
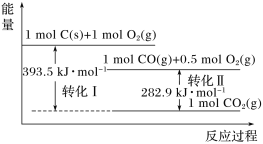
A. 1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g)= 2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)= 2CO(g) ΔH=-221.2 kJ·mol-1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH=-10.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:___________________________。
(2)写出C的酸性溶液与双氧水反应的离子方程式:__________________________________。
(3)写出鉴定E中阳离子的实验方法和现象:_______________________________________。
(4)有学生利用FeCl3溶液制取FeCl3·6H2O晶体,主要操作包括:滴入过量盐酸,_________、冷却结晶、过滤。过滤操作除了漏斗、烧杯,还需要的玻璃仪器为_______________________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:
(1)H3PO2及其与足量氢氧化钠反应生成的NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①在H3PO2中,磷元素的化合价为________在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:________(填化学式)。
②NaH2PO2是________(填“正盐”或“酸式盐”),其溶液中离子浓度由大到小的顺序应为________
(2)次磷酸(H3PO2)可以通过电解的方法制备.工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式________
②分析产品室可得到H3PO2的原因________(结合一定的文字分析)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置分别进行如下实验,各离子方程式正确及各组物质反应后,溶液的导电性比反应前增强的是( )
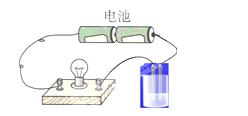
A.向硝酸银溶液中通入少量氯化氢:Ag++Cl-=AgCl↓
B.向亚硫酸溶液中通入氯气:H2SO3+C12+H2O=SO42-+4H++2Cl-
C.向FeBr2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl-
D.向NaOH溶液中通入少量氯气:2OH-+Cl2=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向10L容积不变的密闭容器中加入1.0molNH2COONH4,发生反应NH2COONH4(s)![]() CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
CO2(g)+2NH3(g) ΔH>0。5min达到平衡时,测得容器中NH2COONH4(s)的物质的量为0.2mol。下列说法正确的是
A. 0~5min内,v(CO2)=0.16mol·L-1·min-1
B. 氨气体积分数不变时,该反应一定达到平衡状态
C. 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大
D. 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com