【答案】
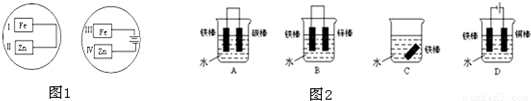
分析:(1)根据原电池和电解池的工作原理来确定电极反应、总反应以及电极区域的现象;
(2)同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,据此分析解答;
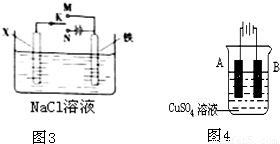
(3)根据金属的防护,若K置于N处,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,金属铁为正极,金属铁被保护;
(4)电镀池中,作阳极的是镀层金属,做阴极的是待镀金属,金属阳离子在该极上发生得电子的还原反应,在原电池中,负极金属更易被腐蚀.
解答:解:(1)第一个装置是原电池,Zn为负极,溶液中的氧气在Ⅰ处得电子生成OH
-,所以Ⅰ处变红;第二个装置是电解池,铁为阳极,溶液中的H
+在Ⅳ处得电子,破坏了锌片附近水的电离平衡,使得OH
-浓度增大,所以Ⅳ处变红,Ⅱ处是原电池的负极,电极反应为:Zn-2e
-=Zn
2+,Ⅳ处是电解池的阴极,发生电极反应为:2H
++2e
-=H
2↑,该两种情况下发生的总反应的离子方程式:2Fe+O
2+H
2O=2Fe(OH)
2、Fe+2H
2O

Fe(OH)
2+H
2↑,若把III的铁片改为碳棒,写出该处电极为惰性电极,发生的电极反应式:2Cl
--2e
-=Cl
2↑,
故答案为:Ⅰ、Ⅳ;Zn-2e
-=Zn
2+;2H
++2e
-=H
2↑;2Fe+O
2+H
2O=2Fe(OH)
2;Fe+2H
2O

Fe(OH)
2+H
2↑;2Cl
--2e
-=Cl
2↑;
(2)A、该装置中铁作负极,铁易失去电子而易被腐蚀;
B、该装置中铁作正极,铁电极上易得电子而被保护;
C、铁不发生电化学腐蚀;
D、铁作电解池的阴极而被保护;
同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,所以铁棒被腐蚀由易到难的顺序ACBD,
故答案为:A>C>B>D;
(3)A、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故A正确;
B、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,若X为锌板,K置于N处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故B正确;
C、若X为碳棒,K置于N处,形成电解池,金属铁为阴极,该极上氢离子得电子放出氢气,氢离子减少,阳极上是氯离子失电子产生氯气,导致溶液的pH增大,故C错误;
D、若X为碳棒,K置于M处形成原电池,氯离子移向负极金属铁,K置于N处,Cl
-均向阳极碳棒电极移动,故D错误;
故选AB;
(4)①在铁件的表面镀铜的电镀池中,作阳极A的是镀层金属铜,Cu-2e
-=Cu
2+,阴极B是金属铁,故答案为:铁;Cu-2e
-=Cu
2+;
②电镀时两极反应为:A电极:Cu-2e
-=Cu
2+,B电极上:Cu
2++2e
-=Cu,若电镀时电路中通过的电子为0.2mol,则A极上质量减少6.4g,B极上质量增加6.4g,所以A、B两极质量相差12.8g,故答案为:12.8.
点评:本题考查了原电池和电解池的工作原理的应用,考查学生分析和解决问题的能力,综合性强,难度大.

 Fe(OH)2+H2↑,若把III的铁片改为碳棒,写出该处电极为惰性电极,发生的电极反应式:2Cl--2e-=Cl2↑,
Fe(OH)2+H2↑,若把III的铁片改为碳棒,写出该处电极为惰性电极,发生的电极反应式:2Cl--2e-=Cl2↑, Fe(OH)2+H2↑;2Cl--2e-=Cl2↑;
Fe(OH)2+H2↑;2Cl--2e-=Cl2↑;




