
红磷P(S)和Cl2发生反应生成KCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
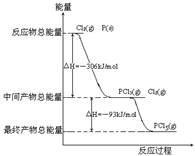 上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解
率α1等于 ;若反应温度由T1升高
到T2,平衡时PCl5分解率α2,α2 α1
(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2
反应生成中间产物PCl3,然后降温,再和Cl2
反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的
△H3= ;P和Cl2一步反应生成
1mol PCl5的△H4 △H1(填“大于”,“小于”或“等于”);
(5)P Cl5与足量水反应,最终生成两种酸,其化学方程式是 。
科目:高中化学 来源: 题型:

| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如下图所示(图中的△H表示生成1mol产物的数据).| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).
红磷 P(s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成 1 mol 产物的数据).| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 红磷P(s)和Cl2(g)之间的反应为①P(s)+
红磷P(s)和Cl2(g)之间的反应为①P(s)+| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com