
在相同条件下(T=500K),相同体积的甲乙两容器,甲中充入1gSO2和1gO2,乙中充入2gSO2和2gO2,下列叙述中不正确的是( )
A.反应速率:乙>甲 B.平衡混合物中SO2的体积分数:乙>甲
C.SO2的转化率:乙>甲 D.平衡时O2的浓度:乙>甲
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某兴趣小组设计如图所示装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是
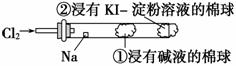
A.钠在氯气中燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空。

(1)A的结构简式是____________________________,名称是________________。
(2)①的反应类型是____________________________,
③的反应类型是__________________________。
(3)反应④的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化
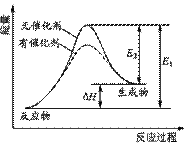 能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
A.该反应为放热反应
B.该反应焓变可表示为△H=-(E1-E2)kJ·mol-
C.催化剂能降低反应的活化能
D.催化剂能改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的百分含量与时间的关系如图2所示。则下列结论正确的是( )
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·L-1·min-1
B.容器中发生的反应可表示为:3X(g)+Y(g) === 2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)实验室利用如右图装置进行中和热的测定。回答下列问题:
(1)该图中有两处实验用品未画出,它们是 、
;
(2)在操作正确的前提下提高中和热测定的准确性的关键是:
。
(3)如果用0.5mol•L-1的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中
和热”将 (填“偏大”、“偏小”、“不变”)原因是
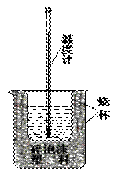 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的应用正确的是
A.常温下干燥氯气与铁不反应,可以用钢瓶储存氯水
B.二氧化硅具有较强的导电性,可用于制造光导纤维
C.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
D.次氯酸钠具有强氧化性,可用于配制消毒液
查看答案和解析>>
科目:高中化学 来源: 题型:
[物质结构与性质]原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29。请用元素符号或化学式回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为 ▲ ;
(2)已知YZ 与XQ2互为等电子体,则1 mol YZ
与XQ2互为等电子体,则1 mol YZ 中含有π键数目为____▲___;
中含有π键数目为____▲___;
(3)Z的气态氢化物沸点比Q的气态氢化物高的多,其原因是 ▲ ;
 (4)X、Z与氢元素可形成化合物H2X2Z4,常用作工业除锈剂。H2X2Z4分子中X的杂化方式为 ▲ ;
(4)X、Z与氢元素可形成化合物H2X2Z4,常用作工业除锈剂。H2X2Z4分子中X的杂化方式为 ▲ ;
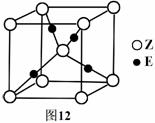
(5)E原子的核外电子排布式为 ▲ ;E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图12所示,该晶体的化学式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
若某原子在处于能量最低状态时,外围电子排布式为4d15s2,则下列说法正确的是
A.该元素原子最外层共有3个电子
B.该元素位于第五周期ⅡA族
C.该元素原子核外第N层上共有9个不同状态的电子
D.该元素原子第四电子层上有5个空轨道
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com