
����Ŀ����27.2g Cu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡ����0.5L������������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���1.0mol/L��NaOH��Һ1.0L����ʱ��Һ�����ԡ�������������ȫ��������������Ϊ39.2g�������й�˵������ȷ����( )
A. Cu��Cu2O�����ʵ���֮��Ϊ2��1
B. ������NO�ڱ�״���µ����Ϊ4.48L
C. ��������ʵ���Ũ��Ϊ2.6mol/L
D. Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2mol
���𰸡�C
��������
��������Һ�м���1.0mol/L ��NaOH��Һ1.0 L����ʱ��Һ�����ԣ�������������ȫ��������Һ������ΪNaNO3��n(NaNO3) = n(NaOH) = 1.0 mol/L��1.0 L=1 mol������ΪCu(OH)2������Ϊ39.2 g������������ʵ���= ![]() = 0.4 mol���ٸ���ͭԪ���غ���n(Cu)+2n(Cu2O) = n[Cu(OH)2]�����Է�Ӧ�����Һ��n[[Cu(NO3)2] = n[Cu(OH)2] = 0.4 mol��
= 0.4 mol���ٸ���ͭԪ���غ���n(Cu)+2n(Cu2O) = n[Cu(OH)2]�����Է�Ӧ�����Һ��n[[Cu(NO3)2] = n[Cu(OH)2] = 0.4 mol��
A. ��Cu��Cu2O�����ʵ����ֱ�Ϊx mol��y mol�����ݶ�����������ϵʽn(Cu)+2n(Cu2O) = n[Cu(OH)2]���з��̼��㣻
B. ����A�����Cu��Cu2O�����ʵ��������õ���ת���غ����n(NO)���ٸ���V=n��Vm����NO�������
C. ����NԪ���غ��֪ԭ������Һn(HNO3) = n(NO) + n(NaNO3)������A�����Cu��Cu2O�����ʵ��������õ���ת���غ����n��NO��������NaԪ�ؿ�֪n��NaNO3��=n��NaOH�����ٸ���c = ![]() �����㣻
�����㣻
D. ��Ӧ�����Һ�м�������������Һ����������������ͭ�����ᷴӦ�����Ϊ��������Һ�����ݵ�Ԫ���غ��֪��Ӧ����Һ��n(HNO3) ʣ��+ 2n[[Cu(NO3)2] = n(NaNO3)���ݴ˼��㡣
A. ��Cu��Cu2O�����ʵ����ֱ�Ϊx mol��y mol�����ݶ��������� 64 x+144 y = 27.2������ͭԪ���غ���x + 2y = 0.4���������̽��x = 0.2��y = 0.1������n(Cu)��n(Cu2O) = 0.2��0.1 = 2��1����A����ȷ��
B.���ݵ���ת���غ��֪��3n(NO) = 2n(Cu) + 2n(Cu2O)������3n(NO) = 2��0.2 mol + 2��0.1 mol�����n(NO) = 0.2 mol�����Ա�״����NO�����Ϊ0.2 mol��22.4 L/mol = 4.48 L����B����ȷ��
C. ����NԪ���غ��֪n(HNO3) = n(NO) + n(NaNO3)�����ݵ���ת���غ��֪��3n(NO) = 2n(Cu) + 2n(Cu2O)������3n(NO) = 2��0.2 mol + 2��0.1 mol�����n(NO) = 0.2 mol������NaԪ�ؿ�֪n(NaNO3) = n(NaOH) = 1.0 mol/L��1.0 L=1 mol������n(HNO3) = n(NO) + n(NaNO3) = 0.2 mol+1 mol = 1.2 mol������ԭ������Һ��Ũ��Ϊ![]() = 2.4 mol/L����C�����
= 2.4 mol/L����C�����
D. ��Ӧ�����Һ�м�������������Һ����������������ͭ�����ᷴӦ�����Ϊ��������Һ�����ݵ�Ԫ���غ��֪��Ӧ����Һ��n(HNO3)ʣ�� + 2n[Cu(NO3)2] = n(NaNO3)������n(HNO3) ʣ��= n(NaNO3) - 2n[Cu(NO3)2]=1 mol-2��0.4mol = 0.2 mol����D����ȷ��
��ѡC��


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�Ӽ۵��ӹ���3d104S2����Ӧ��(����)
A. �������ڢ�A��B. �������ڢ�B��C. �������ڢ�A��D. �������ڢ�B��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������˵����ȷ����( )
A. ��ͬ���ʵ�����Al��A1(OH)3 �ֱ����Ũ�ȵ�NaOH��Һ��Ӧ������ϵ�о�����ʱ��Al(OH)3���ĵļ����϶�
B. ��Na2CO3��NaHCO3��ɵĻ�����У���n(Na+):n(C)=7:5����n(Na2CO3): n(NaHCO3)=2:3
C. ��ӦN2O4+N2H4��N2+H2O�У�����1 mol N2O4�μӷ�Ӧ������4 mol���ӷ���ת��
D. ��ͬ���ʵ�����Ũ����ֱ���������ͭ������ͭ��Ӧ����������ͭ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е�λ�������ʾ������XԪ�ص�ԭ���ڲ��������������������һ�룬������˵������ȷ���ǣ���
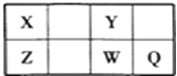
A. ����W�����γ�Na2W2������
B. ��Z��Y��ɵ�����������ʱ�ܵ���
C. W�õ���������Qǿ
D. X�ж���ͬ�������壬��Y������ͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 24 g þ��27 g���У�������ͬ��������
B. ͬ�������������ͳ����У���������ͬ
C. 1 mol��ˮ��1 molˮ�У���������Ϊ2��1
D. 1 mol�����1 mol��ϩ�У���ѧ������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ�����Ư����ɱ������������������ˮ�Ͷ�����̼�����ʷ�����Ӧ�����治��ʱ���ױ��ʡ�ijʵ��С���Թ�������Ϊ�о��������������ʵ�顣
(1)̽��һ��Na2O2��Ʒ�Ƿ��Ѿ����ʣ�ȡ������Ʒ�������ܽ⣬����__________��Һ��������а�ɫ������֤��Na2O2�Ѿ����ʡ�
(2)��ʵ��С��Ϊ�˴��Բⶨ�������Ƶ�������������ȡ��m g��Ʒ�����������ͼװ�����ⶨ�������Ƶ�����������
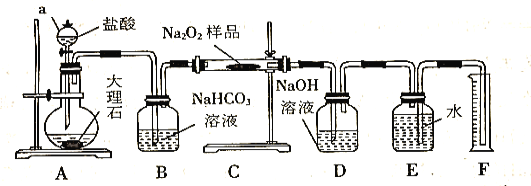
��װ��D��������_________________________________��
�ڽ��������Ӻ��Ժ�����еĵ�һ��������_________________________________��
��д��װ��C�з�����Ҫ��Ӧ�Ļ�ѧ����ʽ_________________________________��
�ܷ�Ӧ�������ڶ�ȡʵ����������������ʱ������Ϊ��������_______________(�����)��
a����ȡ�������ǰ������ȴ������
b��������ͲʹE��F��Һ��߶���ͬ
c�������밼Һ�����͵���ƽʱ��ȡ��Ͳ��ˮ�����
�ݶ�����Ͳ��ˮ�������������ɱ�״�������������ΪVmL������Ʒ�й������Ƶ���������Ϊ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50 mL 0.018 mol/L��AgNO3��Һ�м���50 mL 0.02 mol/L���������ɳ�������֪��Ksp(AgCl)��1.8��10��10mol2��L��2�������ɳ��������Һ��c(Ag��)��pH�ֱ�Ϊ
A. 1.8��10��7mol/L,2 B. 1��10��7mol/L,2 C. 1.8��10��7mol/L,3 D. 1��10��7mol/L,3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com