
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

下列说法不正确的是( )
A. 通过计算,可知系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1
B. 通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1
C. 若反应H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1 , 则a>286
D. 制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法
【答案】C
【解析】
此题考查盖斯定律的应用,根据盖斯定律可以求得总反应方程式中的焓变。
A. 根据盖斯定律进行方程式的加合,①式+②式+③式,得系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)=H2(g)+![]() O2(g) ΔH= +286 kJ· mol-1,A正确,故A不符合题意。
O2(g) ΔH= +286 kJ· mol-1,A正确,故A不符合题意。
B. 根据盖斯定律进行方程式的加合,②式+③式+④式,得系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =+20kJ·mol-1,B正确,故B不符合题意。
C. 若反应H2(g)+![]() O2(g)=H2O(g)生成气体水,放出的热量小,故a<286,C不正确,故C符合题意。
O2(g)=H2O(g)生成气体水,放出的热量小,故a<286,C不正确,故C符合题意。
D. 根据系统(Ⅰ)(Ⅱ)总的热化学方程式得出:放出的热量较少的是硫碘循环硫化氢分解法,D正确,故D不符合题意。
故答案选C。


科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硫及其化合物的说法正确的是( )

A.浓硫酸具有脱水性,可用于干燥氨气
B.加氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有![]()
C.二氧化硫能使溴水、酸性高锰酸钾溶液褪色,因其有漂白性
D.如图装置中血红色褪去,可以验证 SO2 的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,
![]()
第3周期中Z元素的简单离子半径最小。下列说法正确的是( )
A.Z位于第3周期ⅠA族 B.X、Y、Z、W、Q这五种元素的最高正价均等于其所在族的族序数
C.X的最高价氧化物对应的水化物和X的氢化物形成的化合物属于共价化合物 D.Y元素气态氢化物比W元素的气态氢化物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的电池其原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液。下列说法中不正确的是( )

A.放电时电池负极的电极反应为H2-2e-+2OH-=2H2O
B.放电时K+移向正极
C.放电时镍电极的电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O
D.该反应过程中KOH溶液的浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
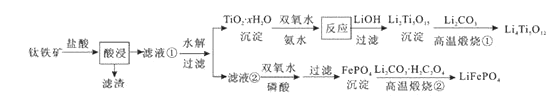
下列说法不正确的是( )
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”),溶液中c(Na+) _______c(CH3COO-)(填“ >” 或 “=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈_______(填“酸性”,“中性”或“碱性”),溶液中c(Na+)_______c(CH3COO-) (填“ >” 或“=”或“<”)。
(3)酸碱中和反应是_______反应 ,盐类水解是_______反应,(填吸热,放热)。盐类水解的本质是_______水的电离,(填促进,抑制)。升高温度_______盐类的水解。(填促进,抑制)
(4)弱电解质的电离常数只受_______影响,升温电离常数_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。下列有关说法正确的是

A. 制取NaHCO3的反应是利用其溶解度比较小
B. 除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两上实验:(N2O4![]() 2NO2 △H > 0)
2NO2 △H > 0)

(a)将两容器置于沸水中加热方
(b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是
A.(a)甲>乙(b)甲<乙B.(a)甲>乙(b)甲=乙
C.(a)甲<乙(b)甲>乙D.(a)甲>乙(b)甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com