
����Ŀ���������ֳƻ����������������ԭ�ϣ�����Ҫ�ɷ�ΪFeS2��850�桫950��ʱ�����������գ����ܷ������з�Ӧ���������N2��O2�����Ϊ4��1����4FeS2+11O2��2Fe2O3+8SO2��
��1������35%����������Ʒ�����ʲ�������FeS2�ĺ���Ϊ________��
��2����1t������FeS2��ȫ��Ӧ��������״����SO2________m3��
��3��ΪʹFeS2������ȫ����Fe2O3����ҵ��ʹ�ù�������������������20%ʱ������¯����SO2���������Ϊ����________��
���𰸡� 65.6% 373.3 12.7%
��������
���⣨1�����������������m������FeS2�ĺ���Ϊx����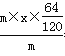 ��35%�����x��0.656����FeS2�ĺ���Ϊ0.656��
��35%�����x��0.656����FeS2�ĺ���Ϊ0.656��
��2�����ݷ�Ӧ����ʽ��֪1 t������FeS2��ȫ��Ӧ��������״����SO2�����ʵ�����1000000g/120g��mol -1��2���ڱ�״���µ����Ϊ1000000g/120g��mol -1��2��22.4L/mol��373333.3L��373.3m3��
��3����FeS2Ϊ1 mol�����ݻ�ѧ����ʽ4FeS2+11O2��2Fe2O3+8SO2������ȫ������Ҫ��n��O2����2.75 mol������n��SO2����2 mol����������25%���������Ϊ��2.75mol/0.2��1.2��16.5 mol����SO2�������Ϊ��2mol����16.5mol+2mol-2.75mol����0.127��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ũҩ������Һ��������������ʢ�ţ�����Ϊ�������ũҩ������ѧ��Ӧ���ڸ÷�Ӧ�У�����������
A.��������B.�ǻ�ԭ��C.������ԭ��ӦD.����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��X�pY�pZ�pW�pQ��ԭ������������Xԭ�Ӻ��������������Ǵ�����������2����Y�ķ�����YF3�����и�ԭ�Ӿ����������8�����ȶ��ṹ��Z�pW�dz���������Z��ͬ������ԭ�Ӱ뾶����Ԫ�ء�W�ļ�������ͬ���������Ӱ뾶��С�ġ�X��Zԭ������֮����Q��ԭ��������ȡ�����˵����ȷ����
A. ��ͬ������Z��W���ʷֱ�������ϡ���ᷴӦʱ��Z�ĵ��ʻ�õ�������
B. X��Q�γɵĻ������Z��Q�γɵĻ�����Ļ�ѧ��������ͬ
C. ����������Ӧ��ˮ��������ԣ�X��W
D. Y�ļ���̬�⻯����Q�ĵ��ʷ�Ӧ�������Dz�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ��Ӧ������ͬ��Ԫ��֮�����(����)
A. Zn+2HCl![]() ZnCl2+H2��
ZnCl2+H2��
B. 2H2S+SO2![]() 3S��+2H2O
3S��+2H2O
C. H2+CuO![]() Cu+H2O
Cu+H2O
D. 2H2O![]() 2H2��+O2��
2H2��+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳ��ð���Ϊԭ���Ʊ����ᣬ������һ���dz���Ҫ�ķ�ӦΪ��4NH3+5O2![]() 4NO+6H2O���÷�Ӧ��������Ϊ________����ԭ��Ϊ________���õ����ŷ���ʾ��������ԭ��Ӧ����ת�Ƶķ������Ŀ��________�����б�״����VL������ȫ��Ӧ����ת��n�����ӣ����ӵ�������NA���ɱ�ʾΪ________��д������ĸ�ı���ʽ����
4NO+6H2O���÷�Ӧ��������Ϊ________����ԭ��Ϊ________���õ����ŷ���ʾ��������ԭ��Ӧ����ת�Ƶķ������Ŀ��________�����б�״����VL������ȫ��Ӧ����ת��n�����ӣ����ӵ�������NA���ɱ�ʾΪ________��д������ĸ�ı���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Zn��Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
��1�������ֽ��������ᷴӦ���������жϣ�ʵ���г�ѡ���С��ͬ�Ľ���Ƭ�⣬����Ҫ����________��________��ͬ����ѡ��һ������Һ��֤���ֽ����Ļ����ԣ����Լ�________��
��2��������Zn��Cu���缫��Ƴ�ԭ��أ����ܲ��������ȶ��ĵ�������ȷ��Zn��Cu�Ļ�ԣ��������淽���л���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ_______��

������װ����������ӦʽΪ��________��
��ijС��ͬѧ����Zn��Fe��Ϊ�缫��ֻ��һ��ԭ���֤�����ֽ����Ļ�ԣ���������Һ���ѡ��________��
A.0.5molL��1�Ȼ�������Һ
B.0.5molL��1�Ȼ�ͭ��Һ
C.0.5molL��1����
D.0.5molL��1�Ȼ�������0.5molL��1�Ȼ�ͭ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ù�ಬ˿պȡij��ɫ��Һ������ɫ���������գ�����ʻ�ɫ������ɫ��Һ��
A.ֻ��Na+B.һ����Na+��������K+
C.һ����Na+��K+D.������Na+��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���֪��������ȼ�յĻ�ѧ����ʽΪ��
C(s)+O2(g)=CO2(g) ��H=-393.5kJ��mol-1
2H2(g)+O2(g)=2H2O(l) ��H=-572kJ��mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-890kJ.mol-1��
�ڴ������£�����������ȷ����
A. C(s)+2H2(g)=CH4(g) ��H=+75.5kJ��mol-1
B. CH4(g)+O2(g)=C(s)+2H2O(g) ��H=-1283.5kJ.mol-1
C. 1molH2(g)��3molCH4(g)ȼ�չ�����2956kJ.mol-1
D. ��ͬ������H2��CH4���ȼ��ʱ��H2�ų�������Լ����CH4�ų���������2.57��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��ʱ����2.0molA(g)��2.0molB(g)�������Ϊ1L���ܱ������У���һ����������������Ӧ:A(g)+B(g)![]() 2C(g)+D(s)��H<0��tʱ�̷�Ӧ�ﵽƽ��ʱ��C(g)Ϊ2.0mol������˵����ȷ����
2C(g)+D(s)��H<0��tʱ�̷�Ӧ�ﵽƽ��ʱ��C(g)Ϊ2.0mol������˵����ȷ����
A. tʱ�̷�Ӧ�ﵽƽ��ʱ��A(g)���������Ϊ20%
B. T��ʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Kc=2
C. tʱ�̷�Ӧ�ﵽƽ�����С���������ƽ�������ƶ�
D. ��ͬ�����£�����1.0molA(g)��1.0molB(g)����ͬ���������ﵽƽ���A(g)��ת����Ϊ50%
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com