
【题目】空气质量与我们的健康息息相关,目我国通过检测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2、和CO是其中3项中的污染物.
(1)上述3种气体直接排入空气后会引起酸雨的气体有(填化学式).
(2)处理酸雨市场采用NaClO2溶液作为吸收剂,可同时对烟气进行脱硫、脱硝,其中脱硫反应ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 该反应的平衡常数K的表达式为;
(3)利用反应6NO2+8NH3═7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,写出电极A的电极方程式 , 当标况下有4.48L被处理时,通过电极B的电子数为 
【答案】
(1)SO2、NO2
(2)K= ![]()
(3)2NH3+6e﹣+6OH﹣=N2↑+6H2O;0.8NA
【解析】解:(1)SO2、NO2和CO中,能和空气中的水蒸气反应的有SO2、NO2 , SO2+H2O=H2SO3 H2SO3进一步被氧气氧化为硫酸,3NO2+H2O=2HNO3+NO,硫酸和硝酸融入雨水,形成酸雨,在空气中CO不能与水反应,故答案为:SO2、NO2;(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积,所以ClO2﹣+2SO32﹣2SO42﹣+Cl﹣ , 平衡常数为:K= ![]() ,故答案为:K=
,故答案为:K= ![]() ;(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由﹣3价变为0价,所以NO2发生还原反应、NH3发氧化反应,则A是负极、B是正极,负极电极方程式为2NH3﹣6e﹣+60H﹣=N2+6H2O,所以电极A极反应式为2NH3﹣6e﹣+6OH﹣═N2+6H2O,当有4.48 L NO2 被处理时,参加反应的NO2物质的量为0.2mol,转移电子物质的量=0.2mol×[4﹣0]=0.8mol,故答案为:2NH3+6e﹣+6OH﹣=N2↑+6H2O; 0.8NA .
;(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由﹣3价变为0价,所以NO2发生还原反应、NH3发氧化反应,则A是负极、B是正极,负极电极方程式为2NH3﹣6e﹣+60H﹣=N2+6H2O,所以电极A极反应式为2NH3﹣6e﹣+6OH﹣═N2+6H2O,当有4.48 L NO2 被处理时,参加反应的NO2物质的量为0.2mol,转移电子物质的量=0.2mol×[4﹣0]=0.8mol,故答案为:2NH3+6e﹣+6OH﹣=N2↑+6H2O; 0.8NA .
(1)从空气污染的角度分析,利用酸雨形成的过程相关知识解决;(2)反应的平衡常数表达式为生成物的浓度幂之积比上反应物浓度幂之积;(3)根据方程式知,6NO2+8NH3═7N2+12H2O中NO2中N元素化合价由+4价变为0价、NH3中N元素化合价由﹣3价变为0价,所以NO2发生还原反应、NH3发生氧化反应,则A是负极、B是正极,负极电极方程式为2NH3﹣6e﹣+60H﹣=N2+6H2O,正极反应式为2NO2+8e﹣+4H2O=80H﹣+N2 , 由此分析解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )

A. 该装置将化学能转化为电能,电流方向为b![]() a
a
B. 催化剂b表面O2发生还原反应,其附近酸性增强
C. 催化剂a表面的反应是:SO2+2H2O-2e-=SO42-+4H+
D. 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,利用培养皿探究SO2的性质,实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面扣在上面。表中对实验现象的描述或解释不正确的是

选项 | 实验现象 | 解释 |
A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
D | 品红溶液褪色 | SO2具有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考如图,按要求回答下列问题: 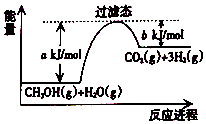
(1)甲醇质子交换膜燃料电池将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O反应生成CO2和H2 . 若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变化是(填“增大”、“减小”、“不变”).请写出CH3OH(g)和H2O(g)反应的热化学方程式 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+ ![]() O2(g)CO2(g)+2H2(g)△H=﹣c kJ/mol
O2(g)CO2(g)+2H2(g)△H=﹣c kJ/mol
又知H2O(g)H2O(l)△H=﹣d kJ/mol.
则甲醇燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A. 检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 检验试液中的SO32-:试液![]() 气体
气体![]() 褪色
褪色
C. 检验试液中的I-:试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D. 检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将少量的铝投入过量的氢氧化钠溶液中充分反应,下列有关所得混合溶液的叙述正确的是( ) 
A.该溶液中,Ag+、K+、NH4+、SO42﹣可以大量共存
B.该溶液中,Na+、OH﹣、NO3﹣、CO32﹣不能大量共存
C.向该溶液中逐滴加入AlCl3溶液,生成沉淀与加入AlCl3溶液关系如图
D.向该溶液中逐滴加入稀盐酸,生成沉淀与加入稀盐酸关系如图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5L物质的量浓度为2mol/L的K2SO4溶液中K+的物质的量浓度为( )
A.2mol/L
B.4mol/L
C.1 mol/L
D.20mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com