
| A. | NaHSO4 和 Ba(OH)2 | B. | MgCl2和 NH3•H2O | C. | NaAlO2 和 H2SO4 | D. | AlCl3 和 NaOH |
分析 A、NaHSO4和Ba(OH)2反应,无论是前者滴入后者,还是后者滴入前者,现象都是产生白色沉淀;
B、无论氨水是否过量,氯化镁和氨水反应都生成氢氧化镁沉淀;
C、NaAlO2和H2SO4反应,当前者滴入后者时,后者开始足量,先有沉淀立即溶解,最终有沉淀,当后者滴入前者时,前者开始足量,先有沉淀后溶解,最终无沉淀;
D、前者逐滴滴入后者,发生AlCl3+4NaOH═3NaCl+NaAlO2+H2O、3NaAlO2+AlCl3+6H2O═4Al(OH)3↓+3NaCl,后者逐滴滴入前者发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
解答 解:A、NaHSO4和Ba(OH)2反应,当前者滴入后者时,后者开始足量,反应方程式为:NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,当后者滴入前者时,前者开始足量,反应方程式为:2NaHSO4+Ba(OH)2 =Na2SO4+BaSO4↓+2H2O,无论是前者滴入后者,还是后者滴入前者,现象都是产生白色沉淀,故A正确;
B、无论氨水是否过量,氯化镁和氨水反应都生成氢氧化镁沉淀,所以反应现象相同,故B正确;
C、NaAlO2和H2SO4反应,当前者滴入后者时,后者开始足量,先有沉淀立刻溶解,先有沉淀反应方程式为:2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓由于H2SO4过量,生成的Al(OH)3立刻被硫酸中和,反应方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,当溶液中铝元素全部变为Al3+时,它与滴入的AlO2-发生双水解反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓现象是最终有沉淀;当后者滴入前者时,前者开始足量,先有沉淀,反应方程式为:2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓ 后溶解是由于硫酸过量,反应方程式为:3H2SO4+2Al(OH)3═Al2(SO4)3+6H2O,最终无沉淀,故C错误;
D、因前者逐滴滴入后者,发生AlCl3+4NaOH═3NaCl+NaAlO2+H2O、3NaAlO2+AlCl3+6H2O═4Al(OH)3↓+3NaCl,现象为先没有沉淀后有沉淀生成;
而后者逐滴滴入前者发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,现象为先有沉淀生成后沉淀逐渐消失,则现象不同,故D错误;
故选AB.
点评 本题考查利用滴加顺序不同来判断反应的现象,明确发生的化学反应是解答本题的关键,难度不大.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 向H2SO4酸化的KI溶液中滴加H2O2:2I-+H2O2+2H+=I2+2H2O | |
| B. | 小苏打治疗胃酸过多:H++HCO3-=H2O+CO2↑ | |
| C. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO | |
| D. | 检验溴乙烷中含有的溴元素:CH3CH2Br+Ag+=AgBr↓+CH3CH2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 和E同主族 |
| C | 1mol C单质能与冷水反应,在标准状况下生成11.2L H2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负一价阴离子的电子层结构与Ar原子相同 |
 ;
;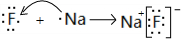 ;
;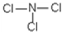 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
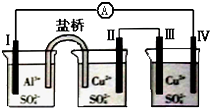
| A. | 电极Ⅱ逐渐溶解 | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电流方向:电极Ⅰ→A→电极Ⅳ | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO -)>c(CH3COOH) | B. | c(CH3COO -)>c(Na+)>c(H+)>c(OH -) | ||
| C. | c(Na+)=c(CH3COO -)=0.01mol•L-1 | D. | c(CH3COOH)+c(CH3COO -)=0.02mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com