
【题目】在标准状况下①13.44 L CH4②6.02×1023个HCl分子③27.2 g H2S ④0.4 mol NH3,下列对这四种气体的关系从大到小表达错误的是
A. 体积②>③>①>④ B. 质量②>③>④>①
C. 密度②>③>④>① D. 氢原子个数①>③>④>②
【答案】B
【解析】
①n(CH4)=13.44L÷22.4L/mol=0.6mol;
②n(HCl)=![]() ;
;
③n(H2S)=27.2g÷34g/mol=0.8mol;
④n(NH3)=0.4mol。
A.在相同的温度和压强下,气体的物质的量越大,气体的体积就越大。体积:②>③>①>④,A正确;
B.各种气体的质量分别是:①0.6mol×16g/mol=9.6g;②1mol×36.5g/mol=36.5g;③0.8mol×34g/mol=27.2g;④0.4mol×17g/mol=6.8g。质量:②>③>①>④,B错误;
C.在相同的外界条件下,气体的相对分子质量越大,气体的密度就越大。相对分子质量:CH4:16;HCl:36.5;H2S:34;NH3:17,所以密度:②>③>④>①,C正确;
D.各种气体中H原子的物质的量分别是:①2.4mol,②1.0mol,③1.6mol,④1.2mol。因此各种气体的氢原子数关系是:①>③>④>②,D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O下列说法不正确的是
MnCl2+Cl2↑+2H2O下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1 mol Cl2,转移的电子数为2 NA
C. 转移电子的物质的量为1 mol时,生成标准状况下Cl2的体积为11.2 L
D. 每消耗1 mol MnO2,起还原剂作用的HCl消耗4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放的工业废水中主要含Na+、HSO3ˉ、SO42-,研究小组欲测定其中HSO3ˉ的浓度,设计如下三个方案。
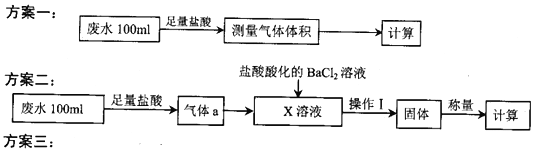
量取20.00mL废水试样,用0.02moL·K-1MnO4标准溶液进行滴定。记录数据,计算。
回答下列问题
(1)利用右图所示的装置完成方案一
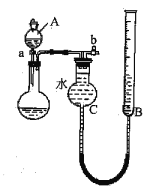
①仪器A的名称是______________。
②读数前,应进行的操作是____________________________。
③该方案存在较大的误差,可能的一种原因是____________________________。
(2)①方案二中吸收气体a的“X溶液”可能是______________ (填标号)。
a.Na2SO3溶液 b.双氧水 c.硝酸钠溶液 d.H2SO4酸化的KMnO4溶液
②若Ⅹ为次氯酸钠,写出气体a与X溶液反应的离子方程式____________________________。
③该方案中,操作I包含的操作名称依次为______________。
(3)①方案三设计的下列滴定方式中,最合理的是______________ (填标号)。该方案是否需要指示剂? ______________ (填“是”或“否”),原因是__________________________________________。
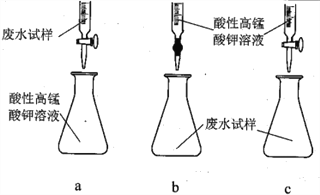
②滴定记录数据如下表:
滴定前读数/mL | 滴定后读数/mL | |
第一次 | 0.10 | 16.12 |
第二次 | 1.10 | 17.08 |
第三次 | 1.45 | 21.45 |
第四次 | 0.00 | 16.00 |
计算该废水试样中HSO3ˉ的浓度为______________ mol ·L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
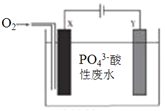
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++O2+4H++4PO43- =4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)金刚石和石墨燃烧反应中的能量变化如图a所示。在通常状况下,金刚石和石墨中,__________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热为__________。

(2)采用电化学法可将二氧化碳转化为甲烷,试写出以氢氧化钾水溶液作电解质时,该转化的电极反应方程式__________________________________________。
(3)CO2为原料还可合成多种物质。工业上常以CO2(g)与H2(g)为原料合成乙醇。
①已知:H2O(l)=H2O(g) △H=+44kJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
2CO(g)+4H2 (g) ![]() CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1
则:2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(l) △H=___________________。
CH3CH2OH(g)+3H2O(l) △H=___________________。
②下图是一种以烟道气为原料合成乙醇的工作原理示意图。对上述流程的分析,下列说法正确的是_________。

A.该流程至少包含4种形式的能量转化
B.装置X中阴极反应为:2H2O-4e-=4H++O2↑
C.合成塔中生成乙醇的反应是化合反应
D.流程设计体现了绿色化学思想
(4)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图b为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。

① E为该燃料电池的___________极(填“正”或“负”)。F电极上的电极反应式为___________。
② 镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答以下问题:
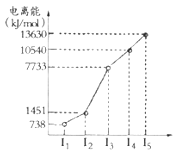
(1)第四周期的某主族元素,其第一至五电离能数据如图所示,则该元素对应原子的M层电子排布式为____________。
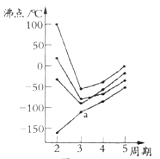
(2)如图所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化.每个小黑点代表一种氢化物,其中a点代表的是______。
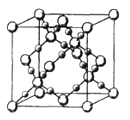
(3)CO2在高温高压下所形成的晶体其晶胞如图所示.该晶体的熔点比SiO2晶体________(填“高”或“低”),该晶体中碳原子轨道的杂化类型为______。
(4)化合物(CH3)3N与盐酸反应生成[(CH3)3NH]+,该过程新生成的化学键为____(填序号)。
A.离子键 B.配位键 C.氢键 D.非极性共价键
若化合物(CH3)3N能溶于水,试解释其原因:_________________________。
(5)一种新型储氢化合物A是乙烷的等电子体,其相对分子质量为30.8,且A是由第二周期两种氢化物形成的化合物。加热A会慢慢释放氢气,同时A转化为化合物B,B是乙烯的等电子体。化合物A的结构式为__________________(若含有配位键,要求用箭头表示)
(6)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,熔体中P-Cl的键长只有198 nm和206 nm两种,这两种离子的化学式为______________________;正四面体形阳离子中键角小于PCl3的键角原因为_____________________________;若PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因______________________。
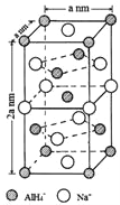
(7)氢化铝钠(NaAlH4)是一种新型轻质材料, NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如下图所示。NaAlH4晶体中,与Na+紧邻且等距的AlH4- 有_________个;NaAlH4晶体的密度为___________g·cm-3(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。

实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下现象与电化腐蚀无关的是
A. 黄铜(铜锌合金)制作的铜锣不易产生铜绿
B. 生铁比软铁芯(几乎是纯铁)容易生锈
C. 铁质器件附有铜质配件,在接触处易生铁锈
D. 银质奖牌久置后表面变暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属催化的新型碳-碳偶联反应是近年来有机合成的研究热点之一,如:
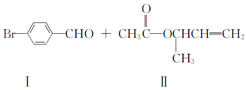
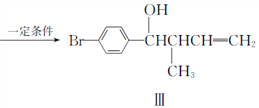
(1)化合物Ⅰ的分子式为_____________。其苯环上的一氯代物有______________种。
(2)化合物Ⅱ中所含官能团的名称是__________________。
(3)属于芳香化合物的是___________________(填代号)。
(4)若化合物Ⅲ中的羟基被Br取代后,试写出该取代产物能发生的所有反应类型_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com