
【题目】(1)CO2的摩尔质量为_________,3.01×1023个CO2的质量为_________,在标准状况下其体积为_________;
(2)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸_________mL(保留两位有效数字);
(3)已知离子反应:RO3n﹣+6I﹣+6H+═R﹣+3I2+3H2O,推断:n=_________,R元素在RO3n﹣中的化合价是_________。
【答案】44g/mol 22g 11.2L 5.4 1 +5
【解析】
(1)CO2的摩尔质量为44g/mol;3.01×1023个CO2的物质的量n=![]() ,质量m=nM=0.5 mol ×44g/mol=22g;根据V=n×22.4mol/L计算0.5molCO2在标准状况下的体积是11.2L;
,质量m=nM=0.5 mol ×44g/mol=22g;根据V=n×22.4mol/L计算0.5molCO2在标准状况下的体积是11.2L;
(2)配制的溶液含有的硫酸的物质的量是:n=cV=1mol/L×0.10L=0.1mol,需要质量分数为98%的浓硫酸(密度为1.84g/cm3)的体积是:![]() ≈0.054L=5.4mL;
≈0.054L=5.4mL;
(3)化学反应方程式中,等号左右两边电荷守恒,所以-n+(-6)+(+6)=-1,故n=1;离子中各元素的化合价的代数和与所带电荷数相等,设R元素的化合价为x,所以(-2)×3+x=-1,解得x=+5;故R元素在RO3n﹣中的化合价是+5。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。完成下列填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | ||
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ |
(1)表中元素,原子半径最大的是_____(填写元素符号);原子核外有两个未成对电子的元素是_____________(填写编号);③和⑥两元素形成化合物的电子式为__________。
(2)⑥⑦两种元素最高价氧化物对应的水化物中,酸性最强的是__________(填化学式)。
(3)比③、④、⑤三种元素的简单离子半径: > > (填离子符号________;元素④最高价氧化物对应的水化物与硫酸反应的离子方程式为________________________。
(3)用一个化学方程式来证明元素②比元素⑥的非金属性强__________________________。
(4)③和⑥两元素形成的化合物溶于水,其溶液中离子浓度由大到小的顺序:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将50g溶质质量分数为w1,物质的量浓度为c1 的较浓氨水沿玻璃棒加人到u mL水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀氨水。若c1 =2c2,则:
A. w1>2w2,u>50 B. w1<2w2,u<50 C. w1=2w2,u<50 D. w1<2w2,u>50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个装置的说明符合实验要求的是( )

A. 装置①:实验室中若需制备较多量的乙炔可用此装置
B. 装置②:实验室中可用此装置来制备硝基苯,产物中因混有NO2而显黄色
C. 装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘
D. 装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,商品名富血铁,含铁量高(33%),较难被氧化为三价铁,在胃内铁不直接游离,对胃黏膜刺激较小,是一种治疗缺铁性贫血的安全有效的铁制剂。实验采用反丁烯二酸(又称富马酸)为原料,在适当的pH条件下与Fe2+形成配合物。如图是合成富马酸铁的一种工艺路线:

回答下列问题:
(1)A的结构为_________(用结构简式或键线式表示),由A生成B的反应类型为__________
(2)C在NaOH乙醇溶液中反应的方程式为________
(3)富马酸的结构简式为__________
(4)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出_____ LCO2(标况下);富马酸的同分异构体中(包含顺反异构),同为二元羧酸的还有____(写出结构简式)。
(5)用石油裂解中得到的1,3-丁二烯合成丁烯二酸时,![]() 是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到
是关键的中间产物。请用反应流程图表示从H2C=CH-CH=CH2到![]() 的变化过程._____________
的变化过程._____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中C02的含量及有效地开发利用CO2,已引起了全世界的普遍重视。
(1)CO2加氢合成DME(二甲醚)是解决能源危机的研究方向之一。
①2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
CH3OCH3(g)+3H2O(g)△H= -122.4kJ·mol-1
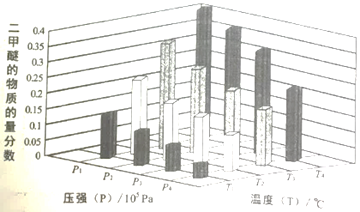
某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,反应到达平衡时、改变压强和温度,平衡体系中CH3OCH3(g)的物质分数变化情况如图所示,则p1______p2(填“>”“<”或“=”,下同)。若T1、P1,T3、P3时平衡常数分别为K1、K3,则K1______K3,T1、P1时H2的平衡转化率为____________。
②在恒容密闭容器里按体积比为1:3充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列能说明平衡一定向逆反应方向移动的是______(填序号)。
A. 反应物的浓度增大 B. 混合气体的密度减小
C. 正反应速率小于逆反应速率 D. 氢气的转化率减小
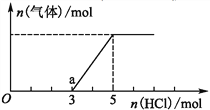
(2)将一定量的CO2气体通入氢氧化钠的溶液中,向所得溶液中边滴加稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。请回答:通入1mol HCl时,溶液中所含溶质的化学式_____________,a点溶液中各离子浓度由大到小的关系式为___________________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其![]() 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为![]() mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________mol·L-1.
mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为__________mol·L-1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com