
【题目】镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。
(1)Ni在元素周期表中的位置是_____,其价电子层中有_______个未成对电子。
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。
①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是_____________。
②其分子中σ键与π键数目之比为_____________________。
③写出一种与配体CO互为等电子体的阴离子符号_____________________。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为_______________,若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有________________种。
(3)金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为____。
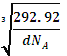
(4)NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为______;若阿伏加德罗常数的值为NA,晶体密度为d g·cm-3,则该晶胞中最近的O2-之间的距离为_______________pm。

【答案】 第四周期,第Ⅷ族 2 Ni(CO)4属于分子晶体,分子间以范德华力结合,较弱,容易被破坏 1∶1 CN- (或C22-) sp3杂化 2 Ni3C60 91∶6 ![]() ×
× ×1010或
×1010或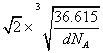 ×1010
×1010
【解析】(1)Ni的原子数序为28,位于周期表第四周期第Ⅷ族,原子核外电子排布为1s22s22p63s23p63d84s2,3d能级有2个未成对的电子;(2)①Ni(CO)4属于分子晶体,分子间以范德华力结合,较弱,容易被破坏,故其熔、佛点较低;②Ni(CO)4分子中含有4+4=8个σ键和![]() 个π键,所以其数目之比为1:1;③CO为2原子分子,电子数为14,对应的等电子体为CN- 或C22- ;④NH3中N原子形成3个δ键,孤电子对数为
个π键,所以其数目之比为1:1;③CO为2原子分子,电子数为14,对应的等电子体为CN- 或C22- ;④NH3中N原子形成3个δ键,孤电子对数为![]() =1,则为sp3杂化;氨气中含有氢键,易液化,且汽化时吸收大量的热,可用于制冷剂,对应的同分异构体中,正八面体的两个顶点可以是CO或NH3,有2中结构;(3)该晶胞中Ni原子的个数为12×
=1,则为sp3杂化;氨气中含有氢键,易液化,且汽化时吸收大量的热,可用于制冷剂,对应的同分异构体中,正八面体的两个顶点可以是CO或NH3,有2中结构;(3)该晶胞中Ni原子的个数为12×![]() +8+1=12;在该晶胞中含有的C60的个数是:8×
+8+1=12;在该晶胞中含有的C60的个数是:8×![]() +6×
+6×![]() =4,n(Ni):n(C60)=12:4=3:1,所以该材料的化学式为Ni3C60;(4)设1mol Ni0.97O中含Ni2+xmol,Ni3+ (0.97-x)mol,根据晶体仍呈中性,可知2x+3(0.97-x)=2
=4,n(Ni):n(C60)=12:4=3:1,所以该材料的化学式为Ni3C60;(4)设1mol Ni0.97O中含Ni2+xmol,Ni3+ (0.97-x)mol,根据晶体仍呈中性,可知2x+3(0.97-x)=2![]() ,x=0.91mol,(0.97-x)mol=0.06mol,即晶体中Ni2+与Ni3+离子的数目之比为0.91mol:0.06mol=91:6;每个晶胞中氧原子个数为4,镍原子个数为4,若阿伏伽德罗常数的值为NA,晶体密度为d g·cm-3,则晶胞的体积为V=
,x=0.91mol,(0.97-x)mol=0.06mol,即晶体中Ni2+与Ni3+离子的数目之比为0.91mol:0.06mol=91:6;每个晶胞中氧原子个数为4,镍原子个数为4,若阿伏伽德罗常数的值为NA,晶体密度为d g·cm-3,则晶胞的体积为V=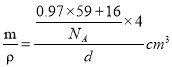 =
=![]() ,晶胞的边长为
,晶胞的边长为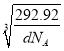 cm=
cm=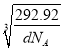 ×1010 pm,该晶胞中最近的O2-之间的距离为边长的
×1010 pm,该晶胞中最近的O2-之间的距离为边长的![]() 倍,故为
倍,故为![]() ×
×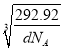 ×1010 pm。
×1010 pm。


科目:高中化学 来源: 题型:
【题目】(1)CO2的摩尔质量为_________,3.01×1023个CO2的质量为_________,在标准状况下其体积为_________;
(2)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸_________mL(保留两位有效数字);
(3)已知离子反应:RO3n﹣+6I﹣+6H+═R﹣+3I2+3H2O,推断:n=_________,R元素在RO3n﹣中的化合价是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
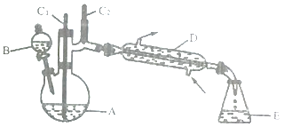
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如下:
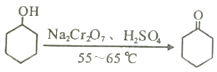
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__________________。
(2)酸性Na2Cr207溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液__________________________________;
②蒸馏不能分离环己酮和水的原因是_____________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏、除去乙醚后,收集151~156℃馏分
b. 水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c. 过滤
d. 往液体中加入NaCl固体至饱和,静置,分液
e. 加入无水MgSO4固体,除去有机物中少量的水
① 上述提纯步骤的正确顺序是______________________________;
② b中水层用乙醚萃取的目的是______________________________________;
③ 上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有_____________,操作d中,加入NaCl固体的作用是______________________________。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行氢氧化铁胶体的制备实验。
甲同学:向1 mol·L-1的氯化铁溶液中加少量氢氧化钠溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25 mL沸水中逐滴加入5~6滴氯化铁饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是____________,若丙同学实验中不停止加热,会看到___________。
(2)氢氧化铁胶体制备的化学方程式为_______________________________;
(3)证明有氢氧化铁胶体生成利用的胶体性质是_______,提纯所制氢氧化铁胶体常用的方法是________。
(4)利用氢氧化铁胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极区附近的颜色逐渐变深,这表明氢氧化铁胶体微粒带__________(填“正”或“负”)电荷;
②若向其中加入饱和硫酸钠溶液,产生的现象是________________________;
③若向其中逐滴加入稀盐酸,产生的现象是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把7.4 g Na2CO3·10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留物的质量是
A. 5.28g B. 2.12g C. 4.22g D. 3.18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某同学欲检验火柴燃烧后的气体中是否含有CO2,他应采用下列方法中的 ()
A.通入澄清的石灰水中B.先通入足量NaHCO3溶液中,再通入澄清石灰水中
C.通入品红溶液中D.先通入足量溴水中,再通入澄清石灰水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。
(1)NH3 是一种很好的配体,氨气分子是_____(填“极性”或“非极性”)分子,NH3 的沸 点_____(填“高于”“等于”或“低于”)AsH3。
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:

图中虚线表示的作用力为_________________________。
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是_____________,其中心原子的杂化轨道类型是________________ 。
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于_____________________ (填编号)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3 B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布式为1s22s22p2 D. Z元素具有两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com