
【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属治炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下

已知:分金液的主要成分为[AuCl4]—;分金渣的主要成分为AgCl;分银液中主要成分为Ag(SO3)2]3—,且存在[Ag(SO3)2]3—![]() Ag++2SO32—
Ag++2SO32—
(1)“分铜”时,单质铜发生反应的化学方程式为_______________________。已知“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率% | 85.7 | 0 | 4.5 | 93.5 |
“分铜”时加入足量的NaC1的主要作用为_________________________________。
(2)“分金”时,单质金发生反应的离子方程式为__________________________。
(3)某小组模拟工业上回收分银渣中的银,过程如下:

中主要反应:AgCl+2SO32—![]() Ag(SO3)23—+C1—
Ag(SO3)23—+C1—
①研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是____________________。
②将Ⅱ中反应的离子方程式补充完整:
_____Ag(SO3)23-+_____OH—+_____==_____+_____SO32—+_____+CO32—
③中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:________________________________________。
(4)工业上,粗银电解精炼时,电解质溶液的pH为1.5~2,电流为5~10A,若用7A的电流电解60min后,得到21.6gAg,则该电解池的电解效率为________%。(保留小数点后位。通过一定电荷量时阴极上实际沉积的金属质量与理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol—1)
【答案】H202+Cu+2H+=Cu2++2H20 使溶出的Ag+形成AgCl进入分铜渣避免银元素的损失 2Au + 6H++7C1-+C103-=2AuCl4-+3H20 S032-被空气中氧气氧化为S042-,使浸出反应平衡左移,浸出率下降 4 6 HCHO 4Ag 8 4H20 随循环次数的增加,浸出液中C(S032-)减小,C (Cl-)增大,AgCl+2S032-![]() Ag(SO3)23-+Cl-平衡左移,浸出率下降 76.6
Ag(SO3)23-+Cl-平衡左移,浸出率下降 76.6
【解析】
(1)“分铜”时,单质铜被双氧水氧化为Cu2+; C1-与Ag+反应生成AgC1沉淀;
(2)由分金液的主要成分为[AuCl4]—可知,金被NaC103氧化为[AuCl4]—;
(3) ①S032-具有还原性,能被空气中氧气氧化;
②Ag(SO3)23—被甲醛还原为银,根据得失电子守恒、电荷守恒、质量守恒配平方离子程式;
③随循环次数的增加,浸出液中C(S032-)减小,C (Cl-)增大;
(4)根据Q=It计算出电量,可知理论上应沉积的金属质量;
(1)“分铜”时,单质铜被双氧水氧化为Cu2+反应离子方程式是H202+Cu+2H+=Cu2++2H20;C1-与Ag+反应生成AgC1沉淀,加入足量的NaC1使溶出的Ag+形成AgCl进入分铜渣避免银元素的损失;
(2)金被NaC103氧化为[AuCl4]—,反应的离子方程式是2Au + 6H++7C1-+C103-=2AuCl4-+3H20;
(3) ①S032-被空气中氧气氧化为S042-,使浸出反应平衡左移,所以反应在敞口容器中进行,浸出时间过长会使银的浸出率降低;
②Ag(SO3)23—被甲醛还原为银,根据得失电子守恒、电荷守恒、质量守恒配平方离子程式为4Ag(SO3)23-+6OH—+ HCHO ==4Ag +8SO32—+4H20+CO32—;
③随循环次数的增加,浸出液中C(S032-)减小,C (Cl-)增大,AgCl+2S032-![]() Ag(SO3)23-+Cl-平衡左移,浸出率下降;
Ag(SO3)23-+Cl-平衡左移,浸出率下降;
(4) Q=It=7×3600,电子物质的量为7×3600÷96500=0.261mol,所以理论上生成银的质量是0.261mol×108g/mol=28.188g,该电解池的电解效率为21.6g÷28.188g×100%=76.6%。


科目:高中化学 来源: 题型:
【题目】18-Ⅰ分子中只有两种不同化学环境的氢,且数目比为3:2的化合物(________)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
Ⅱ奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
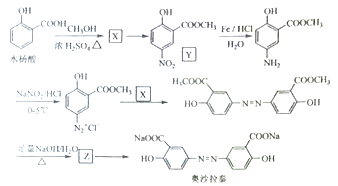
回答下列问题:
(1)X的结构简式为____;由水杨酸制备X的反应类型为_____。
(2)由X制备Y的反应试剂为_________。
(3)工业上常采用廉价的![]() ,与Z反应制备奥沙拉秦,通入的
,与Z反应制备奥沙拉秦,通入的![]() 与Z的物质的量之比至少应为____。
与Z的物质的量之比至少应为____。
(4)奥沙拉秦的分子式为______,其核磁共振氢谱为______组峰,峰面积比为______。
(5)若将奥沙拉秦用![]() 酸化后,分子中含氧官能团的名称为____。
酸化后,分子中含氧官能团的名称为____。
(6)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g) =2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g) =2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__________。
(2)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。

①电源正极为____(填“A”或“B”),阴极的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类向大气中排放的NOx对环境会产生危害,脱除NOx是科学家研究的重要课题。
(1) NOx对环境的一种危害是____。
(2) NH3还原法可将NOx还原为N2进行脱除。
已知:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H1=-1530kJ/mol
N2(g)+O2(g)=2NO(g)△H2=+180kJ/mol
写出NH3还原NO反应的热化学方程式:____。
(3)碱性KMnO4氧化法也可将NOx进行脱除。
①用KMnO4(NaOH)溶液进行烟气中NO的脱除,将该离子方程式补充完整。____NO+____MnO4-+____=NO2-+3NO3-+__MnO42-+______
②下列叙述正确的是____(填字母序号)。
A.将脱除后的混合溶液进行分离可获得氮肥
B.反应后混合溶液中:c( MnO4-)+2c(MnO42-)=c(K+)
C.在不同酸碱性条件下,KMnO4发生氧化还原反应的产物可能不同
③在实验室用KMnO4 ( NaOH)溶液对模拟烟气中的NO进行脱除。若将标准状况下224 L含NO体积分数为10%的模拟烟气进行处理,假设NO最终全部转化为NO3-,理论上需要KMnO4的质量为____g(KMnO4摩尔质量为158 g·mol-l)。
(4)用Pl-g-C3N4光催化氧化法脱除NO的过程如下图所示。

①该脱除过程中,太阳能转化为 ___能。
②在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应:O2+2H++2e-=H2O2;Pl端的反应: ___;NO2最终转化为HNO3的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 稀有气体(如氩)氛围中和加热条件下,可以用镁与TiCl4反应得到钛。
D. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备金属镁的实验流程如下:

已知:一些金属离子转化为氢氧化物沉淀时溶液的pH如表所示
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)如果没有过程①,后果是:__________________________________。
(2)上述流程中被循环使用的物质是:____________。
(3)滤渣2的主要成分为:____________;溶液2中的主要溶质为:_____________。
(4)通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,为保证Mg2+沉淀完全,过程②中控制溶液的pH至少为________。(保留小数点后一位)(已知Mg(OH)2的Ksp=2×10-11,lg2=0.3)
(5)已知MgCl2·6H2O受热时发生水解:MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O,过程③应该如何操作才能得到无水MgCl2?:_______________________________________________。
(6)写出过程④中发生反应的化学方程式:_____________________________________。
(7)为测定菱镁矿中铁的含量。称取12.5 g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,用0.010 mol·L—1H2O2溶液进行滴定。平行测定4组,消耗H2O2溶液的体积数据记录如下表所示。
实验编号 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①根据表中数据,可计算出菱铁矿中铁的质量分数为__________%。(保留两位小数)
②H2O2溶液应装在__________ 滴定管中(填“酸式”或“碱式”)
③误差
a.其它操作均正常,滴定终点时仰视读数会导致所测结果_________。
b.滴定之前没有排除滴定中的气泡会导致所测结果_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为____________。
(2)X与M组成的物质为_____________(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为__________。
(3)Y在周期表中的位置是____________,其含氧酸的化学式为______________。
(4)L与M形成的化合物中L的化合价是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产生活等实际应用中,不能用勒夏特列原理解释的是( )
A. 新制氯水中存在平衡Cl2+H2O ![]() HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
B. 使用更有效的催化剂,提高可逆反应的转化率
C. 工业合成NH3是放热反应,为提高NH3的产率,理论上应采取低温的措施
D. 工业生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率(2SO2+O2![]() 2SO3)
2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香菇是含烟酸较高的食物,烟酸分子中六元环的结构与苯环相似。下列有关烟酸的说法错误的是

A. 所有的碳原子均处同一平面
B. 与硝基苯互为同分异构体
C. 六元环上的一氯代物有5种
D. 1mol烟酸能和3mol氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com