
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 稀有气体(如氩)氛围中和加热条件下,可以用镁与TiCl4反应得到钛。
D. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂。
【答案】D
【解析】
A、根据海水淡化的主要方法分析;
B、苦卤中通入氯气,可以把溴离子氧化为溴单质;
C、氩气做保护气,过量的金属镁在加热条件下与TiCl4反应生成氯化镁和金属钛;
D、工业生产中一般用生石灰作生成氢氧化镁的沉淀剂。
A、海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故A正确;
B、苦卤中通入氯气,可以把溴离子氧化为溴单质,所以工业提溴过程中需要把氯气通入酸化的浓缩海水(或苦卤)中,故B正确;
C、氩气做保护气,过量的金属镁在加热条件下与TiCl4反应生成氯化镁和金属钛,反应方程式是2Mg+TiCl4![]() 2MgCl2 +Ti,故C正确;
2MgCl2 +Ti,故C正确;
D、工业生产中一般用生石灰作生成氢氧化镁的沉淀剂,故D错误;选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
利用莤烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如下:

已知:R1CHO+R2CH2CHO
(1)化合物B中的含氧官能团名称为___________。
(2)A→B的反应类型为____________。
(3)A的分子式为___________。
(4)写出一分子的F通过酯化反应生成环酯的结构简式____________。
(5)写出G到H反应的化学方程式______________。
(6)写出满足下列条件的C的一种同分异构体的结构简式__________。
①能与FeCl3溶液发生显色反应;②分子中有4种不同化学环境的氢。
(7)写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图装置的叙述正确的是
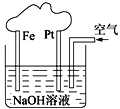
A. 溶液中Na+向Fe极移动
B. 该装置中Pt为正极,电极反应为:O2 + 2H2O + 4e===4OH
C. 该装置中Fe为负极,电极反应为:Fe2e===Fe2+
D. 该原电池装置最终的产物是Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属治炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下

已知:分金液的主要成分为[AuCl4]—;分金渣的主要成分为AgCl;分银液中主要成分为Ag(SO3)2]3—,且存在[Ag(SO3)2]3—![]() Ag++2SO32—
Ag++2SO32—
(1)“分铜”时,单质铜发生反应的化学方程式为_______________________。已知“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率% | 85.7 | 0 | 4.5 | 93.5 |
“分铜”时加入足量的NaC1的主要作用为_________________________________。
(2)“分金”时,单质金发生反应的离子方程式为__________________________。
(3)某小组模拟工业上回收分银渣中的银,过程如下:

中主要反应:AgCl+2SO32—![]() Ag(SO3)23—+C1—
Ag(SO3)23—+C1—
①研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是____________________。
②将Ⅱ中反应的离子方程式补充完整:
_____Ag(SO3)23-+_____OH—+_____==_____+_____SO32—+_____+CO32—
③中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:________________________________________。
(4)工业上,粗银电解精炼时,电解质溶液的pH为1.5~2,电流为5~10A,若用7A的电流电解60min后,得到21.6gAg,则该电解池的电解效率为________%。(保留小数点后位。通过一定电荷量时阴极上实际沉积的金属质量与理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol—1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c((NH4+)_________(填“等于”、“大于”或“小于”) 0.1 mol·L-1NH4HSO4溶液中c(NH4+)
(2)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是______(填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2溶液中2c(SO42-)- c(NH4+)-3c(Al3+)=________ mol·L-1
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是____________; 在b点,溶液中各离子浓度由大到小的排列顺序是___________________。
Ⅱ.pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。
已知H2CO3溶液中存在下列平衡:CO2+H2O![]() H2CO3 H2CO3
H2CO3 H2CO3![]() H+ + HCO3- HCO3-
H+ + HCO3- HCO3-![]() H+ + CO32—图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。
H+ + CO32—图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。

(4)在pH=11时,H2CO3溶液中浓度最大的含碳元素的离子为__________。
(5)由图可知,碳酸的一级电离常数Ka1大约为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.运用烤蓝技术,在钢铁表面形成一层致密的氧化物薄膜
B.古代有“曾青得铁则化为铜”是现代“湿法炼铜”的先驱,它利用了铁置换出铜的原理
C.FeCl3溶液可用于铜质线路板制作,利用了FeCl3能从含有Cu2+的溶液中置换出铜
D.常温下,铁遇浓硝酸发生钝化,所以可用铁质容器盛放浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如下图所示:
2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A. 4 min时反应第一次达到平衡
B. 15 min时降低压强,20 min时升高温度
C. 反应方程式中的x=1,正反应为吸热反应
D. 15~20 min该反应使用了催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com