
【题目】(化学——选修5:有机化学基础)
利用莤烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如下:

已知:R1CHO+R2CH2CHO
(1)化合物B中的含氧官能团名称为___________。
(2)A→B的反应类型为____________。
(3)A的分子式为___________。
(4)写出一分子的F通过酯化反应生成环酯的结构简式____________。
(5)写出G到H反应的化学方程式______________。
(6)写出满足下列条件的C的一种同分异构体的结构简式__________。
①能与FeCl3溶液发生显色反应;②分子中有4种不同化学环境的氢。
(7)写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
【答案】醛基、羰基(或酮基) 氧化反应 C10H16 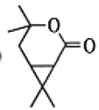



【解析】
A经过臭氧氧化得到B,结合给定信息,B在氢氧化钠,水合氢离子条件下加热可转化为C后,C被酸性高锰酸钾氧化,碳原子数减少,再继续在五氧化二磷作用下分子内酯化成E;E先发生加成反应、后发生水解反应生成F:根据G到H的结构变化及反应条件可知,该反应为酯化反应,则F到G发生了消去反应,G为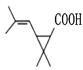 ,据此分析作答。
,据此分析作答。
(1)依据有机物官能团的分类及B的结构简式可知其分子内含氧官能团名称为醛基、羰基(或酮基),
故答案为:醛基、羰基(或酮基);
(2)从流程图中可以看出A→B的反应为加氧氧化,其反应类型应为氧化反应,
故答案为氧化反应;
(3)依据A的结构简式可知,A的分子式为C10H16,
故答案为:C10H16;
(4)F中含羧基与羟基,可发生分子内酯化反应,“酸去羟基醇去氢”则得到的环酯结构简式为: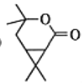
(5)根据H新的酯类化合物,采用逆合成分析法可知,G为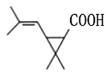 ,G到H反应为酯化反应,其化学方程式为
,G到H反应为酯化反应,其化学方程式为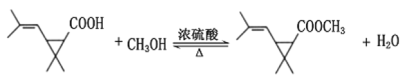 ,
,
故答案为: ;
;
(6)C的分子式为C10H14O,分子的不饱和度 = ![]() ,能与FeCl3溶液发生显色反应,说明分子内有苯环且苯环上直接连接一个羟基;若分子中有4种不同化学环境的氢,根据等效氢思想可得出该同分异构体可以为
,能与FeCl3溶液发生显色反应,说明分子内有苯环且苯环上直接连接一个羟基;若分子中有4种不同化学环境的氢,根据等效氢思想可得出该同分异构体可以为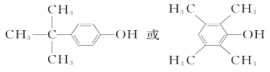 ;
;
故答案为: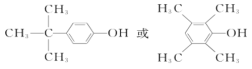 ;
;
(7)依据逆合成分析法可知,若要合成![]() ,得将
,得将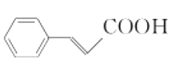 与乙醇发生酯化反应,而
与乙醇发生酯化反应,而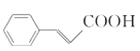 可由
可由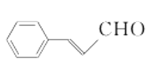 氧化而来,则只需要制备
氧化而来,则只需要制备 即可,根据给定的已知信息,需先将乙醇氧化为乙醛,然后乙醛与原料
即可,根据给定的已知信息,需先将乙醇氧化为乙醛,然后乙醛与原料![]() 先后在氢氧化钠和水合氢离子的作用下,先发生加成反应再发生水解反应生成
先后在氢氧化钠和水合氢离子的作用下,先发生加成反应再发生水解反应生成 ,所以具体合成路线流程图为:
,所以具体合成路线流程图为:
![]()
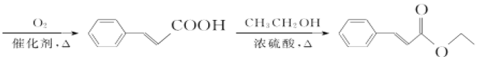 ,
,
故答案为:
![]()
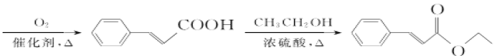 。
。


科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:(已知:稀HNO3可与Fe2+发生氧化还原反应产生NO气体,Fe2+被氧化为Fe3+),下列说法正确的是

A.无法确定原试液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
D.无法确定沉淀C的成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是

A. N极的电极反应式为2HSO3-+2H++e-==S2O42-+2H2O
B. M极的电极反应式为SO2+2H2O-2e-==SO42-+4H+
C. 离子交换膜为阴离子交换膜
D. b为直流电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和 I2在一定条件下能发生反应:H2(g)+I2(g)![]() 2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是
2HI(g),1 mol H2 完全反应放出 akJ热量。已知:(a、b、c 均大于零)。下列说法不正确的是

A.反应物的总能量高于生成物的总能量
B.断开 1 mol H—H 键和 1 mol I—I 键所需能量大于断开 2 mol H—I 键所需能量
C.断开 2 mol H—I 键所需能量约为(c+b+a)kJ
D.向密闭容器中加入 2 mol H2 和 2 mo l I2,充分反应放出的热量小于 2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积一定的密闭容器中加入1 mol N2和3 mol H2发生反应:N2 + 3H2 ![]() 2NH3 △H=-92 kJ·mol-1。下列有关说法正确的是
2NH3 △H=-92 kJ·mol-1。下列有关说法正确的是
A. 向容器中再加入N2,可以加快反应速率
B. 达到化学反应限度时,反应放出热量92 kJ
C. 达到化学反应限度时,正、逆反应速率都为0
D. 单位时间内生成1 mol N2,同时生成3 molH2,说明该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g) =2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g) =2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g) =3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:__________。
(2)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解NO3—的原理如图所示。

①电源正极为____(填“A”或“B”),阴极的电极反应式为___________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。
mC变化如图所示。

已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器内增加压强的变化情况,问:
(1)温度T1________T2(填“大于”、“等于”或“小于”),正反应是________反应(填“吸热”或“放热”)。
(2)如果A、B、C均为气体,则m________2(填“大于”、“等于”或“小于”)。
(3)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”、“减小”或“不变”),平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”,下同)。
(4)当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡______移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列有关说法不正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
B. 空气吹出法是工业规模海水提溴的常用方法。其工艺的其中一个环节是把氯气通入酸化的浓缩海水(或苦卤)中。
C. 稀有气体(如氩)氛围中和加热条件下,可以用镁与TiCl4反应得到钛。
D. 在工业上一般选用氢氧化钠溶液作为图示中的沉淀剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法符合“绿色化学”理念的是

①实验室收集NH3采用图甲所示装置
②实验室中做Cl2与Na反应的实验时采用图乙所示装置
③实验室中采用图丙所示装置进行Cu与浓HNO3的反应
④实验室中采用图丁做NH3与HCl反应生成铵盐的实验
A.①②③B.①②④C.②③④D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com