
【题目】下列做法符合“绿色化学”理念的是

①实验室收集NH3采用图甲所示装置
②实验室中做Cl2与Na反应的实验时采用图乙所示装置
③实验室中采用图丙所示装置进行Cu与浓HNO3的反应
④实验室中采用图丁做NH3与HCl反应生成铵盐的实验
A.①②③B.①②④C.②③④D.①③④
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
利用莤烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如下:

已知:R1CHO+R2CH2CHO
(1)化合物B中的含氧官能团名称为___________。
(2)A→B的反应类型为____________。
(3)A的分子式为___________。
(4)写出一分子的F通过酯化反应生成环酯的结构简式____________。
(5)写出G到H反应的化学方程式______________。
(6)写出满足下列条件的C的一种同分异构体的结构简式__________。
①能与FeCl3溶液发生显色反应;②分子中有4种不同化学环境的氢。
(7)写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c((NH4+)_________(填“等于”、“大于”或“小于”) 0.1 mol·L-1NH4HSO4溶液中c(NH4+)
(2)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是______(填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2溶液中2c(SO42-)- c(NH4+)-3c(Al3+)=________ mol·L-1
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d四个点,水的电离程度最大的是____________; 在b点,溶液中各离子浓度由大到小的排列顺序是___________________。
Ⅱ.pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH。
已知H2CO3溶液中存在下列平衡:CO2+H2O![]() H2CO3 H2CO3
H2CO3 H2CO3![]() H+ + HCO3- HCO3-
H+ + HCO3- HCO3-![]() H+ + CO32—图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。
H+ + CO32—图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后达到平衡时溶液中三种成分的pC-pH图。

(4)在pH=11时,H2CO3溶液中浓度最大的含碳元素的离子为__________。
(5)由图可知,碳酸的一级电离常数Ka1大约为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.运用烤蓝技术,在钢铁表面形成一层致密的氧化物薄膜
B.古代有“曾青得铁则化为铜”是现代“湿法炼铜”的先驱,它利用了铁置换出铜的原理
C.FeCl3溶液可用于铜质线路板制作,利用了FeCl3能从含有Cu2+的溶液中置换出铜
D.常温下,铁遇浓硝酸发生钝化,所以可用铁质容器盛放浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2 ③纯醋酸 ④硫酸钡⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KNO3 ⑧NaOH溶液 ⑨氨水 请用以上物质的序号回答下列问题:
属于强电解质的是________; 属于弱电解质的是_______;在上述状态下能导电的物质是_________。
(2)化学平衡移动原理同样也适用于其它平衡,已知在氨水中存在下列平衡:NH3·H2O ![]() NH4++OH-
NH4++OH-
①向氨水中加入NH4Cl固体时,平衡____________移动,(填“向右”或“向左”),c(OH-)____(填“增大”或“减小”,下同)。
②向氨水中加入MgCl2固体时,平衡_____移动,(填“向右”或“向左”), c(NH4+)____(填“增大”或“减小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到已二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )。

A. 常温下Ka1(H2X)的值约为10-4.4
B. 曲线N表示pH与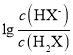
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如下图所示:
2C(g)达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物的量浓度、反应速率分别随时间的变化如下图所示:

下列说法中正确的是
A. 4 min时反应第一次达到平衡
B. 15 min时降低压强,20 min时升高温度
C. 反应方程式中的x=1,正反应为吸热反应
D. 15~20 min该反应使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与材料、信息一起被称为现代社会发展的三大支柱。面对能源枯竭的危机,提高能源利用率和开辟新能源是解决这一问题的两个主要方向。
(1)化学反应速率和限度与生产、生活密切相关,这是化学学科关注的方面之一。某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标况) | 100 | 240 | 464 | 576 | 620 |
①哪一段时间内反应速率最大:__________min(填“0~1”“1~2”“2~3”“3~4”或“4~5”)。
②另一学生为控制反应速率防止反应过快难以测量氢气体积。他事先在盐酸中加入等体积的下列溶液以减慢反应速率但不影响生成氢气的量。你认为可行的是____________(填字母序号)。
A.KCl溶液 B.浓盐酸 C.蒸馏水 D.CuSO4溶液
(2)如图为原电池装置示意图:

①将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是_______(填字母)。
A.铝片、铜片 B.铜片、铝片
C.铝片、铝片 D.铜片、铜片
写出插入浓硝酸溶液中形成的原电池的负极反应式:_______________。
②若A为Cu,B为石墨,电解质为FeCl3溶液,工作时的总反应为2FeCl3+Cu=2FeCl2+CuCl2。写出B电极反应式:________;该电池在工作时,A电极的质量将_____(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol FeCl3,则转移电子的数目为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com