
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验:(已知:稀HNO3可与Fe2+发生氧化还原反应产生NO气体,Fe2+被氧化为Fe3+),下列说法正确的是

A.无法确定原试液中是否含有Al3+、Cl-
B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
D.无法确定沉淀C的成分
【答案】C
【解析】
加入过量稀硫酸无明显变化,说明无![]() 、
、![]() ;
;
加入硝酸钡有气体,说明有亚铁离子存在且被氧化,沉淀为硫酸钡;
加入NaOH有气体,说明存在![]() ,气体为氨气,沉淀B为红褐色氢氧化铁沉淀;
,气体为氨气,沉淀B为红褐色氢氧化铁沉淀;
滤液中通入少量CO2产生沉淀,先与OH-、Ba2+反应,沉淀C中一定含碳酸钡;
因为存在的离子浓度均为0.1molL-1,根据溶液呈电中性,只能含有![]() 、Fe2+、Cl-、
、Fe2+、Cl-、![]() 才能保证电荷守恒,K+、Al3+不能存在,以此解答。
才能保证电荷守恒,K+、Al3+不能存在,以此解答。
A.由上述分析可知,溶液中一定含有Cl-,故A错误;
B.加入过量Ba(NO3)2溶液,溶液中的H+、Fe2+与NO3-发生氧化还原反应,Fe2+被氧化为Fe3+,因此滤液X中大量存在的阳离子有![]() 、Fe3+、Ba2+,故B错误;
、Fe3+、Ba2+,故B错误;
C.由上述分析可知,原溶液中存在的离子为![]() 、Fe2+、Cl-、
、Fe2+、Cl-、![]() ,故C正确;
,故C正确;
D.沉淀C的成分是碳酸钡,故D错误;
故答案为:C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将氯气持续通入紫色石蕊试液中,溶液颜色呈现如下变化:
![]()
关于溶液中导致变色的微粒Ⅰ、Ⅱ、Ⅲ的判断正确的是( )
A.H+、ClO-、Cl2B.H+、ClO-、Cl-C.HCl、ClO-、Cl-D.H+、HClO、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学教材上介绍的干冰晶体是一种立方面心结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离![]() a(其中a为立方体棱长)的CO2有( )
a(其中a为立方体棱长)的CO2有( )

A. 4个 B. 8个 C. 12个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水玻璃(Na2SiO3溶液)广泛应用于耐火材料、洗涤剂生产等领域,是一种重要的工业原料。如图是用稻壳灰(SiO2:65%~70%、C:30%~35%)制取水玻璃的工艺流程:

下列说法正确的是( )
A. 原材料稻壳灰价格低廉,且副产品活性炭有较高的经济价值
B. 操作A与操作B完全相同
C. 该流程中硅元素的化合价发生改变
D. 反应器中发生的复分解反应为SiO2+2NaOH=Na2SiO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的示意图如下。
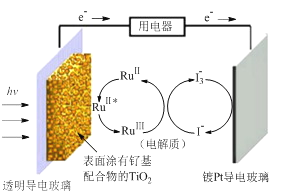
电池工作时发生的反应为:
RuII ![]() RuII *(激发态)
RuII *(激发态)
RuII *→RuIII+e-
I3-+ 2e-→3I-
RuIII+3I-→RuII++ I3-
下列关于该电池叙述错误的是 ( )
A. 电池中镀Pt导电玻璃为正极
B. 电池工作时,I-离子在镀Pt导电玻璃电极上放电
C. 电池工作时,电解质中I-和I3-浓度不会减少
D. 电池工作时,是将太阳能转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol·L-1,c(Cl-)为1.3mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol·L-1NaOH溶液的体积为___________________mL
II.焊接铜件时常用的焊药为氯化铵,其作用是消除焊接处的氧化铜。其反应式为 NH4C1+ CuO→Cu+CuCl2+ N2↑+ H2O
(1)配平,并用双线桥法标出电子转移情况。:____________
(2)该反应中,氧化剂和还原剂的物质的量之比为:___________。
(3)若反应中电子转移了0.3mol,则产生的气体在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯乙烷(![]() )的叙述,正确的是
)的叙述,正确的是
①能使酸性高锰酸钾溶液褪色 ②可以发生加聚反应 ③可溶于水 ④可溶于苯 ⑤能与浓硝酸发生取代反应 ⑥所有原子可能共面
A. ①④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
利用莤烯(A)为原料可制得杀虫剂菊酯(H),其合成路线可表示如下:

已知:R1CHO+R2CH2CHO
(1)化合物B中的含氧官能团名称为___________。
(2)A→B的反应类型为____________。
(3)A的分子式为___________。
(4)写出一分子的F通过酯化反应生成环酯的结构简式____________。
(5)写出G到H反应的化学方程式______________。
(6)写出满足下列条件的C的一种同分异构体的结构简式__________。
①能与FeCl3溶液发生显色反应;②分子中有4种不同化学环境的氢。
(7)写出以![]() 和CH3CH2OH为原料制备
和CH3CH2OH为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com