
【题目】将A气体通入BaCl2溶液,未见沉淀生成,然后通入B气体,有沉淀生成,再加入过量的稀盐酸后沉淀消失,则A、B气体可能是
A.SO2、H2S B.SO2、NO2 C. CO2 、NH3 D.SO2、Cl2
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】0.1 mol某烃在氧气中完全燃烧,将生成物全部通入浓硫酸中,浓硫酸增重9 g,继续通入足量的澄清石灰水中,得到沉淀50 g。求:
(1)该有机化合物的分子式
(2)若分子中只有两个甲基且属于不饱和烃,写出其结构简式(任写两种)
、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下图所示:

(1)请列举海水淡化的一种方法____________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、________、________。
(3)步骤Ⅰ中已经获得Br2,步骤Ⅱ中又将获得的Br2还原为Br-,其目的是____________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,该反应的离子方程式为_____________________________________。由此反应可知,除保护环境外,在工业生产中还应解决的问题是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为_______________________。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论:____________________。
②同学们在两烧杯中还观察到以下现象。其中盛放Na2CO3的烧杯中出现的现象是________(填字母序号)。
a.溶液温度下降 b.溶液温度升高
c.滴入酚酞后呈浅红色 d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中。
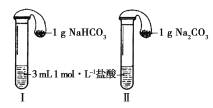
①两试管中均产生气体,________(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是________(填字母序号)。
a.装置Ⅰ的气球体积较大
b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算
d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应:________(写离子方程式) |
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含少量铁,铝,铜,镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
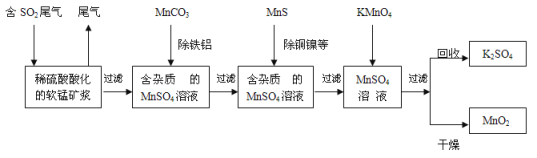
请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(3)已知:25℃、101kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH = -520kJ/mol
S(s)+O2(g)=SO2(g) ΔH = -297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH = -1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是 。
(4)MnO2可作超级电容材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是 。
(5)假设脱除的SO2只与软锰矿浆中MnO2反应。按照图示流程,将5 m3(标准状况)含SO2的体积分数为3 %的尾气通入矿浆,若SO2的脱除率为89.6%,最终每得到MnO2的质量1 kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4 ![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3 的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
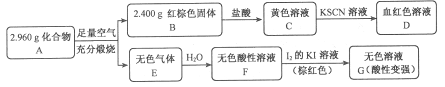
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的工业原料,能溶于水,不溶于乙醇,其工业制法如下。请回答:
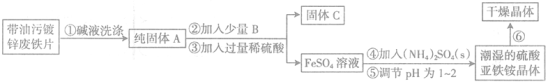
(1)步骤①中碱液洗涤的目的是 。若将碱液换为酸液,可能产生的问题是_ 。
(2)步骤②中B可以是 (填字母),加入少量B的目的是 。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)步骤⑥中要用到少量乙醇洗涤,其目的是 。
(4)用硫酸亚铁按晶体配制溶液时,需加入一定量硫酸,目的是 。工业上常用酸性KMnO4溶液通过滴定的方法测定硫酸亚铁铵样品的纯度,反应的离子方程式为 。准确量取硫酸亚铁铵溶液时,硫酸亚铁铵溶液应盛放于 (填“酸式”或“碱式”)滴定管中。
(5)硫酸亚铁铵晶体的样品中可能含有的杂质离子是 ,实验室的检验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年科学家首次利用X射线观测到化学反应过渡态的形成。在固体催化剂表面“抓取”CO分子和O原子,并“配对”生成CO2分子。 下列关于说法正确的是

A.CO与CO2均为酸性氧化物
B.大量CO2的排放可导致酸雨的形成
C.CO与O形成化学键过程中有电子转移
D.相同条件下,CO的密度比CO2的密度大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com